
用Na2SO3还原MnO4-,如果还原含有2.4×10-3 mol MnO4-的溶液时,消耗30 mL 0.2mol/L Na2SO3溶液,则Mn元素在还原产物中的化合价是( )
A.+1 B. +2 C. +4 D. +5
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
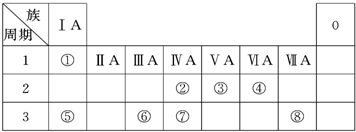


| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |
| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
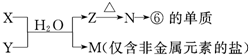
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com