
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温、常压下,16 g O3中含有的氧原子数为NA
B.7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA
C.0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA
D.标准状况下,11.2 L H2O中含有的氢原子数为NA
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
某化学兴趣小组欲测定某品牌味精中氯化钠的含量。该小组的实验步骤如下:
①称取该味精样品10.0g放入烧杯中,并加适量蒸馏水完全溶解;
②加入过量的用硝酸酸化的硝酸银溶液(假定只有NaCl与AgNO3溶液反应)。
③过滤;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得其质量为5.74g;
请回答下列问题:
(1)上述实验步骤③操作中所用到的玻璃仪器有 。
(2)若此品牌味精包装袋上标注:“谷氨酸钠含量≥80.0% ,氯化钠含量≤20.0%”;(假设样品中不含其它杂质)。通过上述实验结果,可计算出样品中氯化钠的质量分数为 ,所以该样品 (填“合格”或“不合格”)。
(3)检验上述实验步骤④所得沉淀是否洗净的方法是:取最后一次洗涤液少量,
。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.NaOH溶液存放在带橡胶塞的细口玻璃瓶中
B.氯水存放在棕色细口玻璃瓶中,并置于冷暗处
C.浓硫酸存放在带橡胶塞的细口玻璃瓶中
D.金属钠用煤油液封于广口玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝粉分别与等体积的盐酸和NaOH溶液反应,同温同压下产生的气体体积比为1︰1,则盐酸和NaOH溶液的物质的量浓度之比为( )
A.2︰3 B.3︰1 C.1︰2 D.1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O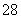 +2I-===2SO
+2I-===2SO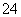 +I2 (慢)
+I2 (慢)
I2+2S2O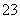 ===2I-+S4O
===2I-+S4O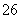 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O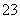 与S2O
与S2O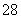 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O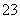 )∶n(S2O
)∶n(S2O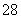 )__________。
)__________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________, 理由是___________________________________。
理由是___________________________________。
(3)已知某条件下,浓度c(S2O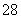 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O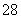 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。

(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________;碘电极作为该电池的________极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com