
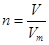 、
、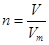 、n=m/M、c=n/V等。
、n=m/M、c=n/V等。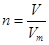 可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol
可知氢气的物质的量是1.12L÷22.4L/mol=0.05mol

科目:高中化学 来源:不详 题型:单选题
| A.摩尔是一种国际基本物理量 |
| B.标准状况下气体摩尔体积约为22.4L |
| C.NA个微粒就是6.02×1023个微粒 |
| D.标准状况下,1mol任何气体物质的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7.8 g Na2O2中所含阴离子的数目是0.2NA。 |
| B.标准状况下,4.48L氦气和重氢气(D2)的混合物中所含中子数为0.4NA, |
| C.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L。 |
| D.足量铜与 0.1L 18.4mol·L-1浓硫酸反应,生成SO2的分子数等于0.92NA。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| B.常温下,1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数小于0.1NA |
| C.标准状况下,2.24 LCl2溶于足量的水中,转移电子总数为0.1NA |
| D.在某氧化还原反应中,还原剂只有I-,则每生成0.3mol I2反应中转移电子的物质的量必为0.6NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.22.4 L NH3中含氮原子数为 NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.100 mL 2.0 mol·L-1 NH4HCO3溶液中NH4+ 数为0.2NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com