
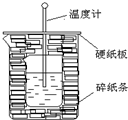
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)NH3•H2O是弱电解质,电离吸热;
(6)先判断温度差的有效性,然后求出温度差平均值.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,故答案为:不相等;相等;
(5)NH3•H2O是弱电解质,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,故答案为:偏小;
(6)三次温度差分别为①2.2℃②2.4℃③3.4℃,第③组数据误差较大,舍去,温度差平均值=$\frac{2.2℃+2.4℃}{2}$=2.3℃,故答案为:2.3.
点评 本题综合考查了中和热的测定、误差分析,可以根据所学知识进行回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
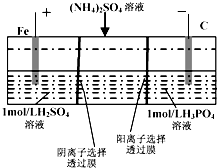 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一个化学变化都伴随着能量的变化 | |
| D. | 新制的氯水中存在着三种分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: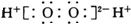 | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com