
电池在生产、生活中应用越来越广泛。下列说法错误的是
A.化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电
B.铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大
C.燃料电池具有能量利用率高、可连续使用和污染轻等优点
D.锂电池是一种高能电池,体积小、重量轻,单位质量能量比高
B
【解析】
试题分析:A.化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,当化学能完全转化为电能时就不能再释放能量.它不能充电反复使用.正确. B.铅蓄电池应用广泛,主要优点是制作方便,但由于质量重,单位重量的电极材料释放的电能小,逐渐被核质比小的锂电池等取代.错误. C.任何可燃性燃料,只要把燃料的失去电子的氧化反应和助燃剂的还原反应分开进行,都可以设计成燃料电池.燃料电池具有能量利用率高、可连续使用和污染轻等优点,正日益成为备受人们喜爱的电池.正确. D.锂小的原子质量为7,每产生1mol电子,消耗金属的质量只有7g,所以相同质量时提供的能量要比其它电池高得多。因此锂电池是一种高能电池,具有体积小、重量轻,单位质量能量比高的优点。正确。
考点:考查电池的种类及铅蓄电池、燃料电池、锂电池的特点等知识。


科目:高中化学 来源: 题型:
| T/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.50 | 2.42 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省上饶市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 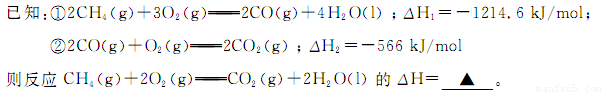
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:??????????????????????????? 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
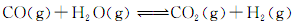 ,得到如下三组数据:
,得到如下三组数据:

①实验1中,以v( H2)表示的平均反应速率为:???? 。
②该反应的正反应为???? (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 ????? (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。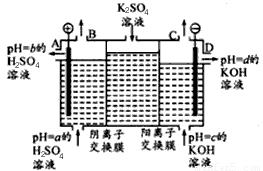
①该电解槽中通过阴离子交换膜的离子数?????? (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ???????? ?? ;
③电解一段时间后,B出口与C出口产生气体的质量比为?? ????????? 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省枣庄市高三4月模拟考试(理综)化学部分 题型:填空题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)= 。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度 (填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g)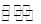 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
|
T/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
⑤.00 |
3.50 |
2.42 |
则500s内N2O5的分解速度v(N2O5)=
;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g)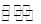 NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2
2N2+6H2O。你认为电解质溶液应显 (填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式
。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
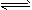 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: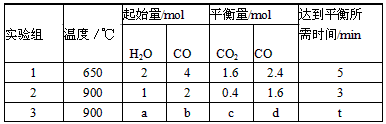
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知在101 kPa时,29 g丁烷气体在氧气中完全燃烧生成液态水和二氧化碳气体,放出QkJ的热量,试写出丁烷完全燃烧的热化学方程式___________________________。
(2)以丁烷为燃料、空气为氧化剂,选用具有催化作用和导电性能的稀土金属材料为电极,用熔融的K2CO3(其中不含O2-和![]() )为电解质组成燃料电池。
)为电解质组成燃料电池。
负极反应:2C4H10+26![]() -52e-====34CO2+10H2O
-52e-====34CO2+10H2O
正极反应:____________________________________。
为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是_________,它来自___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com