
科目:高中化学 来源: 题型:选择题
| A. | 大于14NA | B. | 等于14NA | C. | 小于14NA | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═2HClO+CaSO3↓ | |
| B. | 足量铁屑溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 铝片溶于烧碱溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
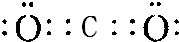 ,Y与W形成的原子个数比为1:1的化合物的电子式是
,Y与W形成的原子个数比为1:1的化合物的电子式是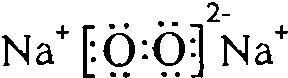 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液直接蒸干 | |
| D. | 称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
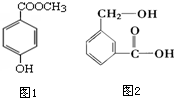 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.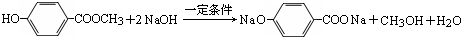 .
.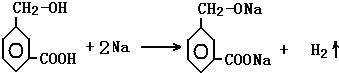 .
.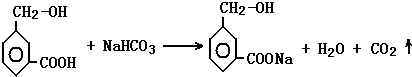 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
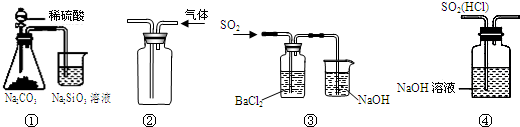
| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②装置收集CO2气体 | |
| C. | 用图③装置制备BaSO3沉淀 | |
| D. | 用图④装置除去SO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 光化学烟雾是氮氧化物和烃的排放引发的环境污染 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 甲烷与二氧化碳一样,也是一种温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCl | D. | CH≡CCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com