
【题目】下列关于物质分类的说法正确的是![]()
①稀豆浆、硅酸、氧化铁溶液都属于胶体
②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
③明矾、冰水混合物、四氧化三铁都不是混合物
④![]() 、MgO、
、MgO、![]() 均属于碱性氧化物
均属于碱性氧化物
⑤葡萄糖、油脂都不属于有机高分子
⑥电解熔融的![]() 可制得金属铝
可制得金属铝
A.①②B.②③C.③⑤D.④⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)是一种很好的供氧剂,其与稀盐酸发生反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O。市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:
按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋,取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴人气袋中至充分反应。

(1)为测定反应生成气体的总体积滴稀盐酸前必须关闭______打开____(均填“K1”、“K2”或“K3”),导管A的作用是________。
(2)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开K1。B中装的固体试剂是_________,为什么要缓缓打开K1?________。
(3)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_______(用含有x、y的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A蒸汽的密度是相同状况下氢气密度的36倍,已知该烃中碳、氢元素的质量比为5:1,回答下列问题:
(1)该烃的相对分子质量为__________________。
(2)该烃的分子式为__________________。
(3)该烃有____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将浓度为![]()
![]() HF溶液加水不断稀释过程中,
HF溶液加水不断稀释过程中,![]() 保持不变,电离度变大,溶液中所有离子的浓度均变小
保持不变,电离度变大,溶液中所有离子的浓度均变小
B.![]() 时,将
时,将![]() 的一元强酸溶液与
的一元强酸溶液与![]() 的一元碱溶液等体积混合后,所得溶液呈酸性或中性
的一元碱溶液等体积混合后,所得溶液呈酸性或中性
C.![]()
![]()
![]() 溶液与
溶液与![]()
![]()
![]() 溶液等体积混合所得溶液中:
溶液等体积混合所得溶液中:![]()
D.对于沉淀溶解平衡![]() ,已知平衡常数
,已知平衡常数![]() ,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:
,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
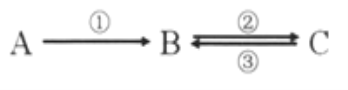
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
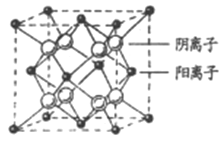
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
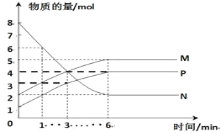
(1)反应化学方程式中各物质的系数比为a:b:c=______。
(2)1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_____。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗amolN,同时消耗bmolM
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com