
| A. | 将40g NaOH溶解在1L水中 | |
| B. | 将25g 胆矾溶于水配成100mL CuSO4溶液 | |
| C. | 将0.1L 10 mol•L-1浓硫酸加入0.9L水中 | |
| D. | 将22.4L HCl气体溶于水配成1L溶液 |
分析 A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol•L-1;
B.25g硫酸铜晶体的物质的量为0.1mol,该溶液浓度为1mol/L;
C.溶液体积不具有加合性,混合后溶液的体积不是1L;
D.据温度、压强对气体摩尔体积的影响分析,气体摩尔体积是指标准状况下1mol任何气体体积约为22.4L.
解答 解:A.40gNaOH的物质的量=$\frac{40g}{40g/mol}$=1mol,溶于水配成1L溶液浓度为1mol•L-1,不是溶剂的体积为1L,故A错误;
B.25g硫酸铜晶体的物质的量为:$\frac{25g}{250g/mol}$=0.1mol,配制的溶液浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,故B正确;
C.0.1L 10 mol•L-1浓硫酸加入0.9L水中,硫酸的物质的量为1mol,但溶液的总体积小于1L,浓度不是1mol/L,故C错误;
D.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故D错误.
故选B.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系;AC为易错点,注意溶液体积不是1L.


科目:高中化学 来源: 题型:解答题
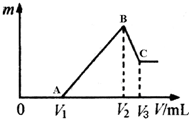 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4gS02与足量氧气反应生成S03,转移电子数小于0.2NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L0.5mol/L稀硝酸中,当生成2.24LNO时,溶液中氮原子数0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
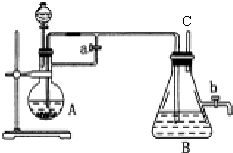
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 CO2后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
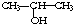 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2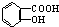 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备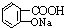
| A. | 只有①③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com