
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同) 0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。 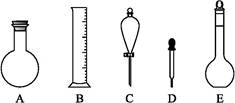
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
| A.50 mL 50 mL |
| B.100 mL 100 mL |
| C.100 mL 150 mL |
| D.250 mL 250 mL |
科目:高中化学 来源: 题型:计算题
实验室中用锌和稀硫酸反应制取氢气。
(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.2倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2 → 2 (1-x) Fe2O3 + 4 SO2
(1)含FeS2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。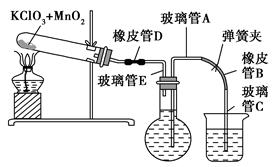
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 mL(保留一位小数)。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 (填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起实验结果偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室需要0.1mol/LNaOH溶液450mL 和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。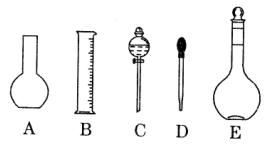
(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为__________g。配制时,其正确的操作顺序是字母表示,
每个字母只能用一次)____________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/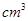 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算
结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用____________mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
资料:(1)草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色;(2)KMnO4在酸性条件的还原产物为Mn2+。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 ______mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;假设二: ;假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求具体的操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室有四个药品橱,已存放如下药品:
| 橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
| 药品 | 盐酸、硫酸 | 氢氧化钠、氢氧化钙 | 红磷、硫 | 铜、锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质的分类正确的是
①混合物:氯水、氨水、水银、福尔马林
②电解质:明矾、冰醋酸、石膏、纯碱
③能导电的物质:铜、盐酸、氯化钠晶体
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥强电解质:烧碱、碳酸钙、氢氧化钡、氯水
| A.②⑤ | B.②③④⑤ | C.②③⑤⑥ | D.全部正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com