
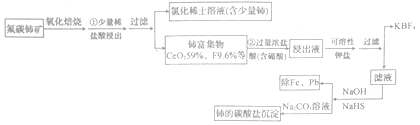
【题目】稀土是一种重要的战略资源、氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
已知:Ⅰ.铈的常见化合价为+3、+4
Ⅱ.Ce4+可以与SO42-结合为[CeSO4]2+
Ⅲ. 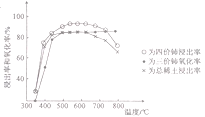
焙烧时铈被氧化成四价,四价铈不易进入溶液,而三价稀土元素易进入溶液。在盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。
回答下列问题:
(1)氟碳铈矿焙烧的目的是__________________;焙烧最适宜温度为______________(填标号)。a.350~450℃ b.550~650℃ C.750℃以上
步骤①中少量铈进入稀土溶液发生反应的离子方程式是_________________________。
(2)铈富集物用含硼酸的盐酸溶液处理,使氟转化为四氟硼酸根离子,然后用可溶性钾盐将四氟硼酸根离子转变为KBF4沉淀并过滤除去。写出生成KBF4的离子方程式:________________。此法处理铈富集物的缺点是____________________。
(3)除云氟离子后向滤液中先加入NaOH溶液,然后再加入NaHS除去铁与铅。加入NaOH溶液的目的是____________________。
(4)写出此流程中铈的碳酸盐沉淀的化学式:______________________。
【答案】 将铈氧化为四价便于与其他稀土元素分离 b 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O K++BF4-=KBF4↓ 产生的氯气会腐蚀设备、污染环境 调节溶液pH Ce2(CO3)3
【解析】(1) 焙烧时铈被氧化成四价,四价铈不易进入溶液,而三价稀土元素易进入溶液,所以
氟碳铈矿焙烧的目的是将铈氧化为四价便于与其他稀土元素分离。由图分析当温度在500-700之间四价铈的浸出率差不多最高,所以选择b.550~650℃. 步骤①中少量铈进入稀土溶液发生反应的离子方程式是8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O 答案:将铈氧化为四价便于与其他稀土元素分离 b 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O
(2)铈富集物用含硼酸的盐酸溶液处理,使氟转化为四氟硼酸根离子,然后用可溶性钾盐将四氟硼酸根离子转变为KBF4沉淀并过滤除去。生成KBF4的离子方程式:K++BF4-=KBF4↓。此法处理铈富集物和酸反应8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O产生的氯气会腐蚀设备、污染环境 。
(3)除云氟离子后向滤液中含有大量的H+先加入NaOH调节溶液的酸碱性,然后再加入NaHS使铁与铅生成沉淀析出。所以加入NaOH溶液的目的是调节溶液pH。
(4)除去铁与铅后的滤液中含有大量的Ce3+,所以铈的碳酸盐沉淀的化学式:Ce2(CO3)3。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______
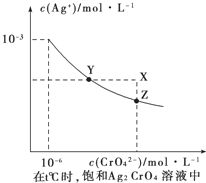
A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨炔是继富勒烯、碳纳米管、石墨烯之后一种新的全碳纳米结构材料,其独特的结构有利于锂离子在面内和面外的扩散和传输。下列有关物质①-④的说法正确的是

A. 物质①、③均能发生加成反应,是不饱和烃
B. 物质②主要由呈六边形非列的碳原子构成,没有导电性
C. 物质①有望成为一种新的导电材料
D. 物质④的分子式为C10H14 ,性质稳定,其一氧代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g)![]() 2CO(g) +2H2(g)的△H =___________。
2CO(g) +2H2(g)的△H =___________。
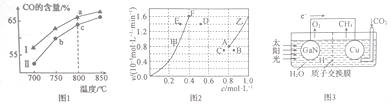
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________。
(3)为了探究反应:CO2(g) +CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________(填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)c(SO42﹣),所以在BaSO4溶液中有c(Ba2+)=c(SO42﹣)=![]()
③将0.1molL﹣1的NaHS和0.1molL﹣1 Na2S溶液等体积混合,所得溶液中有c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S)
④在0.1mol/L氢氧化钠溶液中滴加0.1mol/L醋酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10﹣amolL﹣1.
A. ①②③④ B. 只有②③ C. 只有③④ D. 只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是

A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com