
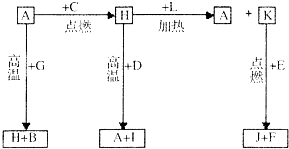
 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题: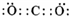 .
.分析 A、B、C、D、E、F 是常见单质,其中A是用量最大,应用最广泛的金属判断为Fe;元素 D 是地壳中含量最多的金属元素判断为Al:G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体判断为H2O,H 是黑色晶体结合转化关系判断为Fe3O4,说明C为O2,A(Fe)+G(H2O)=H(Fe3O4)+B(H2),所以G为H2O,H为Fe3O4,B为H2,H(Fe3O4)+D(Al)=A(Fe)+I(Al2O3);依据H+L=A+K可知,L为为CO,K为CO2,D 元素和 E 元素在周期表中相邻,结合K+E=J+F推断E为Mg;J为MgO,F为C,结合对应的物质的性质以及题目要求解答该题.
解答 解:A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属判断为Fe;元素 D 是地壳中含量最多的金属元素判断为Al:G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体判断为H2O,H 是黑色晶体结合转化关系判断为Fe3O4,说明C为O2,A(Fe)+G(H2O)=H(Fe3O4)+B(H2),所以G为H2O,H为Fe3O4,B为H2,H(Fe3O4)+D(Al)=A(Fe)+I(Al2O3);依据H+L=A+K可知,L为为CO,K为CO2,D 元素和 E 元素在周期表中相邻,结合K+E=J+F推断E为Mg;J为MgO,F为C;
( l )元素 E 为Mg,在元素周期表中的位置为:第三周期,IIA族,
故答案为:三;IIA;
( 2 ) K 为CO2,二氧化碳的电子式为: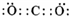 ,
,
故答案为: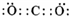 ;
;
(3)H (Fe3O4)和 D (Al)反应的化学方程式:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(4)A (Fe)与 G(H2O) 反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,生成1molH为Fe3O4,转移的电子物质的量8mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;8mol.
点评 本题考查了无机物的推断,为高考常见题型和高频考点,侧重于物质转化关系的应用,物质性质的应用,电子式书写,化学方程式的书写分析,主要考查铁及其化合物性质的分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个120° | B. | 5个108° | C. | 4个109°28′ | D. | 6个109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
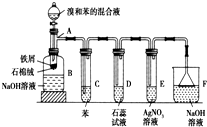 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯能使溴水褪色 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 葡萄糖分子结构中只有一个醛基,所以是单糖 | |
| D. | 生成高分子化合物的常见反应是加聚反应和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 用水鉴别己烷、四氯化碳、酒精三种无色液体 | |
| C. | 将苯和溴水混合制取溴苯 | |
| D. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com