
| A. | 最外层有1个电子的元素一定是金属元素 | |
| B. | 除0族元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,氢化物的稳定性逐渐增强 | |
| D. | 主族元素的原子,最外层电子数少的一定比最外层电子数多的失电子能力强 |
分析 A、非金属氢,最外层只有1个电子;
B、Li原子半径大于第三周期从Al开始向后的元素原子半径;
C、非金属性越强,对应氢化物越稳定;
D、失去电子能力强弱与失去电子数目多少无关,与金属性有关.
解答 解:A.非金属氢,最外层只有1个电子,所以不一定是金属,故A错误;
B.Li原子半径大于第三周期从Al开始向后的元素原子半径,故B正确;
C.同主族元素从上到下,非金属性减弱,元素原子得电子能力逐渐减弱,氢化物的稳定性逐渐减弱,故C错误;
D.失去电子能力强弱与失去电子数目多少无关,与金属性有关,如Ca失去电子能力比Na强,故D错误,
故选B.
点评 本题考查元素周期律,难度不大,B为易错点,注意Cl原子半径在第二周期位置、Li原子半径在第三周期中位置.


科目:高中化学 来源: 题型:选择题
| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
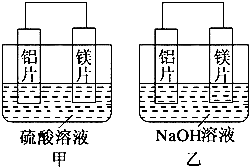
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
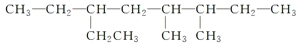 3,4-二甲基-6-乙基辛烷
3,4-二甲基-6-乙基辛烷 邻二乙基苯或1,2-二乙基苯
邻二乙基苯或1,2-二乙基苯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
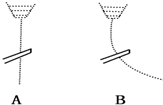 用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )| A. | A是极性分子,B是非极性分子 | B. | A是非极性分子,B是极性分子 | ||
| C. | A、B都是极性分子 | D. | A、B都是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
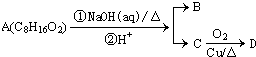 某一有机物A(C8H16O2)可发生如图变化;已知B、D碳原子数相等,且D不发生银镜反应,则A的可能结构有( )
某一有机物A(C8H16O2)可发生如图变化;已知B、D碳原子数相等,且D不发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液和稀硫酸的反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 大理石和稀盐酸反应:2H++CO32-=H2O+CO2↑ | |
| C. | 醋酸和氢氧化钠的反应:CH3COOH+OH-=CH3COO-+H2O | |
| D. | 铜和稀硫酸反应:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6,C4H8 | B. | C3H6,C4H6O | C. | C2H6,C3H6O2 | D. | CH4O,C3H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
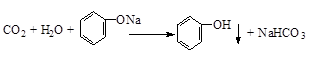 .
.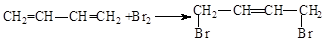 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com