
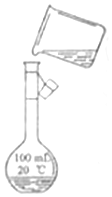
 为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):分析 由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶(剩余少量液体停止加热)得到NaCl,
(1)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先除去镁离子或硫酸根离子,再除去钙离子,过滤后,最后加盐酸,据此进行分析;
(2)②MgCl2和NaOH反应生成Mg(OH)2和NaCl,③Na2SO4和BaCl2反应生成BaSO4和NaCl;
(3)BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,据此进行分析;
(4)若过滤前先加盐酸,前面所生成的沉淀会被盐酸反应重新变为离子进入溶液,据此进行分析;
(5)实验室配置250mL容量瓶,应用250mL,注意溶液时要用玻璃棒引流.
解答 解:(1)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先加入②氢氧化钠溶液除去镁离子或加入③氯化钡溶液除去硫酸根离子,再加入适量①除去除去钙离子,然后过滤除去难溶物,最后加盐酸,除去过量的碳酸钠、氢氧化钠,所以试剂的顺序为②③①或 ③②①,
故答案为:B;
(2)②MgCl2和NaOH反应生成Mg(OH)2和NaCl,故化学方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaC,③Na2SO4和BaCl2反应生成BaSO4和NaCl,故化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl,
故答案为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是若过滤前先加盐酸,前面所生成的沉淀会被盐酸反应重新变为离子进入溶液,
故答案为:若过滤前先加盐酸,前面所生成的沉淀会被盐酸反应重新变为离子进入溶液;
(5)实验室配置250mL容量瓶,应用250mL,而不是100mL容量瓶,注意溶液时要用玻璃棒引流,读
故答案为:转移液体时没有用玻璃棒引流;容量瓶用的是100ml.
点评 本题考查粗盐的提纯,题目难度不大,把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| B. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ/mol 则稀硫酸溶液与稀氢氧化钡溶液反应的反应热△H=2×(-57.3)kJ/mol | |
| D. | 相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能X可能大于Y | |
| B. | 气态氢化物的稳定性:HmY小于HmX | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | X和Y形成化合物时,X显正价,Y显负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、萃取、蒸馏、过滤 | B. | 蒸馏、过滤、蒸发、蒸发 | ||
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 常温下,C(s)+H2O(g)?CO(g)+H2(g) 不能自发进行,则该反应的△H>0 | |
| C. | 石墨能导电,所以石墨属于电解质 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 0.5NA个氯气分子的物质的量是0.5mol | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与HNO3 | B. | Cu与FeCl3 | C. | Zn与HCl | D. | FeCl3与NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com