
| A. | 在过渡元素中寻找半导体材料 | |
| B. | 元素周期表中第一列元素都是碱金属元素 | |
| C. | 现行元素周期表是按照元素相对原子质量又小到大的顺序排列 | |
| D. | M层电子为奇数的所有主族元素的族序数与该元素原子的M层电子数相等 |
分析 A.在元素周期表中金属与非金属的分界线附近,可以找到半导体材料;
B.元素周期表中第一列元素包含碱金属元素与氢元素;
C.现代元素周期表中,同一横行按核电荷数增大顺序由左而由排列,同一纵行自上而下按电子层递增顺序排列;
D.M层电子为奇数的所有主族元素,M层未排满电子,M层为最外层,主族元素族序数等于最外层电子数.
解答 解:A.在元素周期表中金属与非金属的分界线附近,可以找到半导体材料,在过渡元素中寻找耐高温材料、新型催化剂,故A错误;
B.元素周期表中第一列元素除碱金属元素外,还有氢元素,故B错误;
C.现代元素周期表中,同一横行按核电荷数增大顺序由左而由排列,同一纵行自上而下按电子层递增顺序排列,故C错误;
D.M层电子为奇数的所有主族元素,M层未排满电子,M层为最外层,主族元素的族序数与该元素原子的M层电子数相等,故D正确,
故选:D.
点评 本题考查元素周期表、结构与位置关系,比较基础,有利于基础知识的巩固.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再改变的状态 | |
| B. | 生成NO、O2的速率之比为2:1 | |
| C. | NO2、NO、O2的物质的量浓度比为2:2:1 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 0.1mol•L-1的HCl溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
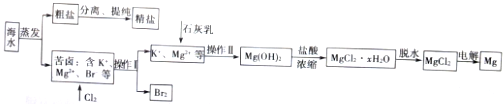
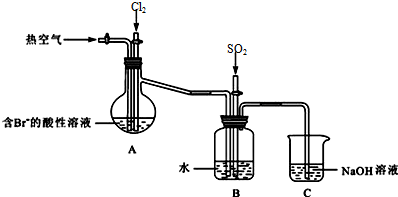
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L NaCl溶液 | B. | 2 mol/L NH4Cl溶液 | ||
| C. | 1.5 mol/L MgCl2溶液 | D. | 2 mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com