
【题目】某化学兴趣小组设计装置,进行实验探究KMnO4与浓盐酸的反应。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)高锰酸钾与浓盐酸的反应中,浓盐酸表现出的性质是_________;若实验中产生2.24 L(标准状况)Cl2,设NA为阿伏加德罗常数的值,则转移的电子数为___________。
(2)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是__________________。
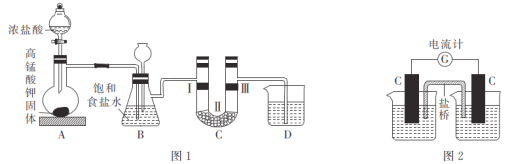
[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(3)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为____________;下列操作会导致所配溶液浓度偏小的是____________(填字母)。
A.容量瓶内壁附有水珠却未干燥处理 B.加水定容时俯视刻度线
C.颠倒摇匀后发现凹液面低于刻度线又加水补足 D.稀释过程中有少量液体溅出烧杯外
(4)左侧烧杯中石墨电极上的电极反应式为________________________________;盐桥中的K+移向____________ (填“左”或“右”)侧烧杯的溶液中。
(5)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是______________________________。
【答案】酸性、还原性 0.2NA 湿润的有色布条、无水氯化钙、干燥的有色布条 500mL容量瓶、胶头滴管 CD MnO![]() +5e-+8H+=Mn2++4H2O 左 氢离子浓度大,KMnO4的氧化性增强,反应速率快能氧化更多的氯离子
+5e-+8H+=Mn2++4H2O 左 氢离子浓度大,KMnO4的氧化性增强,反应速率快能氧化更多的氯离子
【解析】
[实验1](1)高锰酸钾与浓盐酸反应制备Cl2时,HCl部分被氧化,生成了Cl2,体现出了还原性;生成了KCl和MnCl2,体现出酸性;
(2)氯气溶于水生成的HClO具有漂白性,利用饱和食盐水除去HCl的氯气中含有水蒸气,因此先通过湿润的有色布条,探究氯气是否有漂白性;
[实验2](4)KMnO4能够氧化HCl生成Cl2,KMnO4在此过程中得到电子,发生还原反应,左侧石墨电极为正极;
(5)一般条件下,酸性越强,氧化性越强,KMnO4与HCl的反应速率越快。
[实验1](1)高锰酸钾和浓盐酸制备Cl2的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,HCl中有一部分Cl的化合价升高,生成了Cl2,体现出了还原性;有一部分化合价没有变化,形成了KCl和MnCl2,体现出了酸性;根据化学方程式生成5molCl2转移10mol电子,若产生的了2.24L即0.1molCl2,则转移的电子的物质的量为0.2mol,其数目为0.2NA;
(2)装置A生成Cl2,利用饱和食盐水除去Cl2中的HCl,经过B装置的氯气中含有水蒸气,因此先经过湿润的有色布条,再干燥,在经过干燥的有色布条;因此I为湿润的有色布条,Ⅲ为干燥的有色布条,Ⅱ为无水氯化钙,用于干燥Cl2;
[实验2](3)用浓硫酸配制一定物质的量浓度的硫酸时,量取浓硫酸时需要量筒,浓硫酸稀释时,需要烧杯和玻璃棒;转移时,需要500mL容量瓶,定容时需要胶头滴管;因此还需要的玻璃仪器有500mL容量瓶、胶头滴管;
A.容量瓶内壁有水珠未干燥,对溶液中的硫酸的物质的量和溶液的体积均无影响,浓度不变,A不符合题意;
B.加水定容时,俯视刻度线,体积偏小,硫酸的浓度偏大,B不符合题意;
C.颠倒摇匀后,凹液面低于刻度线又补加水,相当于稀释,所配溶液浓度偏小,C符合题意;
D.稀释过程中,有少量液体溅出,则容量瓶溶液中的溶质减小,所配溶液浓度偏小,D符合题意;
答案选CD;
(4)利用原电池制备Cl2,左侧加入的KMnO4和H2SO4,KMnO4得到电子转化为Mn2+,其电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;在原电池中,阳离子向正极移动,左侧KMnO4得到电子发生还原反应,则左侧的石墨电极为正极,则K+向左移动;
(5)在一般情况下,酸性越强,氧化性越强;硫酸的浓度越大,氢离子浓度越大,高锰酸钾的氧化性越强,化学反应速率越快,能氧化更多的氯离子。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是

A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
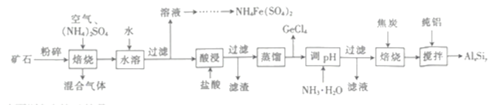
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________。
②“混合气体”的主要成分是_______________ (填化学式).
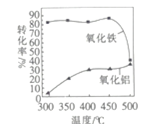
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________。
(3)GeCl4的佛点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________。
(5)假设流程中SiO2 损失了20%,Al2O3 损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每次取20 g海水,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,平均得固态盐a g。该海水中含氯化钠的质量分数是( )
A.大于5a%
B.小于5a%
C.等于5a%
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )
A.所有原子可能在同一平面上B.在同一平面上的原子最多有14个
C.在同一直线上的碳原子有6个D.在同一平面上碳原子可能有11个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
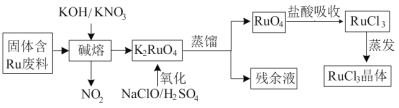
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是

A.E 可以是金属也可以是非金属
B.C 和 D 两种大气污染物,都能用排空气法收集
C.B 的浓溶液具有吸水性,可用来干燥气体
D.实验室制备 F 时,可以将其浓溶液滴入碱石灰中进行制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
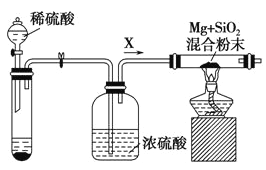
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com