
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同
CO2(g)+H2(g),其正反应放热。现有三个相同
的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充
入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下
列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中的多
D.容器I中CO 的转化率与容器II中CO2 的转化率之和小于1
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
________________________________________________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是
________________________________________________________________________。
(4)晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)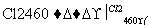 SiCl4
SiCl4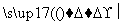 SiCl4(纯)
SiCl4(纯)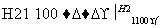 Si(纯)
Si(纯)
写出SiCl4的电子式________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式________________________________________________________________________________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为11。写出该反应的化学方程式____________________________ ____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO可用于合 成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。
成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g)  CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
| 反应时间/min | n(CO) /mol | n(H2O) /mol | n(CO2) /mol | n(H2) /mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
下列说法正确的是 ( )
A.反应在t1 min内的反应速率为v(H2)= mol·L-1·min-1
mol·L-1·min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数 为1
为1
D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝剂,其脱硝反应为:
2NO2(g)+O3(g) N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A | B | C | D |
|
|
|
|
|
| 升高温度,平衡常数减小 | 0~3s内,反应速率为: v(NO2)=0.2mol·L-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的 主要过程包括以下四个反应:
主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g ) △H1 = -90.1kJ•mol-1
) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
(4)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是 。

(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW•h•kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 个电子的能量;该电池的理论输出电压为1.20V,能量密度E = (列式计算。能量密度=电池输出电能/燃料质量,1 kW•h = 3.6×106J)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)2SO3(g)
ΔH=-1 97 kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
97 kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | ||||
| SO2 | O2 | SO3 | Ar | 达到平衡时体系能量的变化 | |
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3=197 kJ
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数相等
D.若在上述条件下反应生成2 mol SO3(s)的反应热为ΔH1,则ΔH1>-197 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
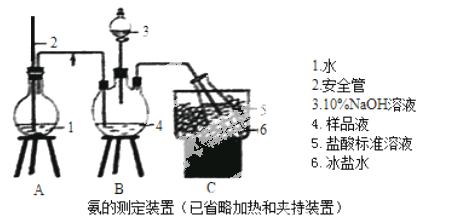
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com