
����Ŀ��U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�U��Y�����ڱ��е����λ����ͼ1��UԪ������Ԫ�����γ�������ɫ���壻W�ǵؿ��к������Ľ���Ԫ�أ�
��1��Ԫ��Z�����ڱ���λ�ڵ��壮�ҹ��״���W��ɵĽ�������ˮ�����������Ϊ��Դ�����ͺ�ˮ��־�ƣ����Ժ�ˮΪ�������Һ���������е�����ʹW��ɵĽ�����������������������ֻҪ�ѵƷ��뺣ˮ�������ӣ��ͻᷢ��ҫ�۵İ⣮��õ�Դ������ӦΪ ��
��2��YO2����ͨ��BaCl2��HNO3�Ļ����Һ�����ɰ�ɫ��������ɫ����VO���йط�Ӧ�����ӷ���ʽΪ �� �ɴ˿�֪YO2��VO��ԭ�Խ�ǿ���ǣ�д��ѧʽ�� ��
��3��V�������̬�⻯���ˮ��Һ�Լ��ԣ��������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ ��
��һ�������£����ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ����ı�����з�Ӧ����x����ƽ����ϵ����x����y����������ѡ����ţ���
ѡ�� | a | b | c | d |
x | �¶� | �¶� | ����H2�����ʵ��� | ��������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ�ļ�ת���� |
����4molV ����ۺ������ϡ��Һ�У�����Fe�����������������ɵ�����ֻ��һ�֣�����ͼ2����ϵ�л���n��Fe2+����n��Fe���仯��ʾ��ͼ ��
��4����ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KZ��CH3COOK��Һ��������Һ�У�����������Ƚ� ��
A.ǰ�߶�
B.һ����
C.���߶�
D.���жϣ�
���𰸡�
��1��VIIA��Al��3e��=Al3+
��2��3SO2+2NO3��+3Ba2++2H2O=3BaSO4��+2NO+4H+��SO2
��3��2NH3+3H2O2=N2+6H2O��bc��
��4��A
���������⣺U��V��W��Y��Z��ԭ��������������Ķ���������Ԫ�أ�W�ǵؿ��к������Ľ���Ԫ�أ���W��AlԪ�أ�U��Y�����ڱ��е����λ����ͼ1������ͼ֪��UΪ�ڶ�����Ԫ�أ�UԪ������Ԫ�����γ�������ɫ���壬��U��CԪ�أ�Y��SԪ�أ�Z��ԭ����������SԪ����Ϊ����������Ԫ�أ�����Z��ClԪ�أ�V�������̬�⻯���ˮ��Һ�Լ��ԣ���V��NԪ�أ����ǰ�������1��Z��ClԪ�أ���ԭ���������7�����ӣ�����Ԫ��ԭ������������������������ȣ�����ClԪ��λ�ڵ�VIIA�壻Al�������͵������Һ����ԭ��أ�Al��ʧ�������������缫��ӦʽΪAl��3e��=Al3+ �� ���Դ��ǣ���VIIA�壻Al��3e��=Al3+����2��SO2����ͨ��BaCl2��HNO3�Ļ����Һ�����ɰ�ɫ��������ɫ����NO������������ԭ��Ӧ������������Ӻ�NO����������Ӻͱ����ӷ�Ӧ�������ᱵ��ɫ��������Ӧ����ʽΪ3SO2+2NO3��+3Ba2++2H2O=3BaSO4��+2NO+4H+ �� ͬһ������ԭ��Ӧ�л�ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ��÷�Ӧ�ж��������ǻ�ԭ����NO�ǻ�ԭ������Զ�������Ļ�ԭ�Խ�ǿ�����Դ��ǣ�3SO2+2NO3��+3Ba2++2H2O=3BaSO4��+2NO+4H+��SO2����3���ٰ�����˫��ˮ����������ԭ��Ӧ���ɵ�����ˮ����Ӧ����ʽΪ2NH3+3H2O2=N2+6H2O�����Դ��ǣ�2NH3+3H2O2=N2+6H2O��
��a���÷ֽⷴӦ�����ȷ�Ӧ�������¶ȴٽ��ֽ⣬���������ʵ����������Ի�������ƽ������������С���ʴ���
b�������¶ȣ��ٽ������ֽ⣬���Ի�ѧƽ�ⳣ��������ȷ��
c���������������ư����ֽ⣬�������������������������䣬���ݦ�= ![]() ֪�����ܶ�������ȷ��
֪�����ܶ�������ȷ��
d�����백��������Ũ������ƽ�������ƶ���������ת���ʼ�С���ʴ���
��ѡbc��
�ۺ���4mol�����ϡ������Һ�У�����Fe���������������ķ�ӦΪFe+4HNO3=Fe��NO3��3+NO��+2H2O��2Fe��NO3��3+Fe=3Fe��NO3��2 �� 4mol��������������������ʱ��Ҫ1molFe��������������������������ʱ��Ҫ0.5mol�������������������ӵ����ʵ�����1.5mol����ͼ��Ϊ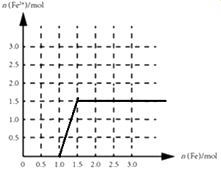 ��
��
���Դ��ǣ�  ����4����ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KCl��CH3COOK��Һ��������Һ�У�KCl�д��� c��K+��+c��OH����=c��H+��+c��Cl������CH3COOK��Һ�д���C��CH3COO����+c��OH����=c��H+��+c��K+�����������Һ�ʼ��ԡ��Ȼ�����Һ�����ԣ�������Һ�м�����Ũ����ȣ�c��H+����KCl��CH3COOK������CH3COOK��Һ��������Ũ��С����ѡA��
����4����ͬ�¶��£�����������ʵ���Ũ�ȶ�Ϊ0.1mol/L��KCl��CH3COOK��Һ��������Һ�У�KCl�д��� c��K+��+c��OH����=c��H+��+c��Cl������CH3COOK��Һ�д���C��CH3COO����+c��OH����=c��H+��+c��K+�����������Һ�ʼ��ԡ��Ȼ�����Һ�����ԣ�������Һ�м�����Ũ����ȣ�c��H+����KCl��CH3COOK������CH3COOK��Һ��������Ũ��С����ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.01��1023�����������ij״���µ����Ϊ22.4L�����״���µ�����Ħ�����Ϊ
A. 11.2L/mol B. 22.4L/mol C. 44.8L/mol D. 67.2L/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����Һ�нᾧ�����ľ��嶼���ᾧˮ
B.����ʧȥ�ᾧˮһ���Ƿ绯�Ľ��
C.�绯�볱�������������෴�Ĺ���
D.ij������Һ��ȴ�����������Һ���DZ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������н������·�Ӧ��CO��g��+H2O��g��CO2��g��+H2��g�������������ݣ�
ʵ�� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | |||
CO | H2O | CO2 | H2 | CO2 | ||
1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
����˵����ȷ���ǣ� ��
A.����ӦΪ���ȷ�Ӧ
B.ʵ��1�У�CO��ת����Ϊ80%
C.650��ʱ����ѧƽ�ⳣ��K= ![]()
D.ʵ��1�ټ���1.0 mol H2O�����´ﵽƽ��ʱ��n��CO2��Ϊ1.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֽ�������A��B���ԭ���ʱ��������������A��B����A��D���ԭ���ʱ��AΪ������B��E����ԭ���ʱ���缫��ӦʽΪ��E2��+2e����E��B��2e����B2+��A��B��D��E��������ǿ������˳��Ϊ�� ��
A.A��B��E��D
B.A��B��D��E
C.D��E��A��B
D.D��A��B��E
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��ȷ�Ӧ����
A.������ԭ����ͭB.�����ķֽ�C.������������ȼ��D.̼��Ƹ��·ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л������������ң�����ʽΪC2H302C1��������ˮ��ɵñ���1mol����2mol�ҷ�Ӧ��һ�ֺ��ȵ�����C6H804Cl2�����ɴ��ƶϼĽṹ��ʽΪ�� ��
A.HCOOCH2Cl
B.ClCH2CH2OH
C.CH2ClCHO
D.HOCH2CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ڵ����ӣ�����Һ�в��ܴ���������� �� ��
A. Mg2+ K+ NO3- Cl- B. K+ Na+ Mg2+ SO42-
C. H+ SO42- Ba2+ NO3- D. Ca2+ H+ NO3- Cl-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com