
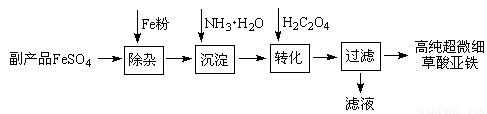
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
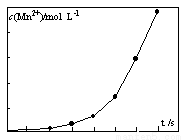
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。
(1)NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解。(2分)
(2)(NH4)2SO4(2分)
(3)【解析】
由题意知,C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5 2
n 20.4×10-3×0.2000mol
解得 n=0.0102mol (4分)
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。(2分)
【解析】
试题分析:(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解
(2)沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀的同时还有硫酸铵生成,所以副产品是(NH4)2SO4
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为20.4×10-3×0.2000×5/2=0.0102mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中若温度不变,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
考点:考查物质制备,对操作、图像的分析,氧化还原反应对计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:填空题
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H= -556.0 kJ·mol-1
③ H2O(g)=H2O(l)? △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液 D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:选择题
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
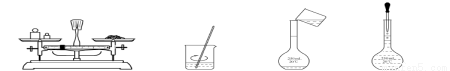
A.称量 B.溶解 C.转移 D.定容
查看答案和解析>>
科目:高中化学 来源:2015届江苏省教学协作体高二上学期期末化学试卷(解析版) 题型:选择题
工业用洗净的废铜作原料来制备硝酸铜。为了节约原料和防止污染,宜采取的方法是
A.Cu Cu(NO3)2
Cu(NO3)2
B.Cu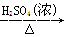 CuSO4
CuSO4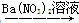 Cu(NO3)2
Cu(NO3)2
C.Cu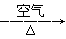 CuO
CuO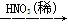 Cu(NO3)2
Cu(NO3)2
D.Cu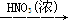 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:选择题
下列各组离子在溶液中能大量共存的是
A.Cu2+、Mg2+、SO42-、NO3- B.H+、Mg2+、SO42-、ClO-
C.Ag+、Na+、NO3-、Cl- D.NH4+、Ba2+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(选修)(解析版) 题型:填空题
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。且B的核磁共振氢谱显示有3组不同的峰。
(1)A的分子式是 。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) 。
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 。
②A不能发生的反应是(填序号) 。
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(必修)(解析版) 题型:选择题
下列物质中,既含离子键又含共价键的是
A.CaCl2 B.NH4Cl C.CCl4 D.CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com