
已知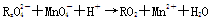 变化过程中,0.2 mol
变化过程中,0.2 mol 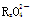 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为 。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
(4)配平题中的离子方程式并将配平后的式子写在下面横线上
28.(1)RO2 (2) 2 (3)0.64mol
(4) 5R2O42- + 2MnO4- +16 H+ = 10RO2 + 2Mn2+ + 8 H2O
【解析】
试题分析:(1)根据Mn化合价从+7到+2,氧化剂为 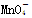 ,氧化产物是RO2;(2)反应中的还原剂只有RxO42-一种。0.2 mol RxO42-失0.4 mol电子,据此列:0.2 mol×(4-6/x)x=0.4 mol,得x=2。反应中
,氧化产物是RO2;(2)反应中的还原剂只有RxO42-一种。0.2 mol RxO42-失0.4 mol电子,据此列:0.2 mol×(4-6/x)x=0.4 mol,得x=2。反应中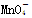 得0.4 mol e-,据此列:n(
得0.4 mol e-,据此列:n(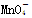 )×5=0.4 mol,n(
)×5=0.4 mol,n(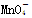 ) =0.08 mol。由反应前H+所带正电荷数与RxO42-、
) =0.08 mol。由反应前H+所带正电荷数与RxO42-、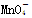 所带负电荷数的差跟反应后Mn2+所带正电荷数相等列:n(H+)×1-0.08 mol×1-0.2 mol×2=0.08 mol×2,得n(H+)=0.64 mol。(4)根据反应的物质的量之比等于化学计量数之比,配平的离子方程式为:(4) 5R2O42- + 2MnO4- +16 H+ = 10RO2 + 2Mn2+ + 8 H2O。
所带负电荷数的差跟反应后Mn2+所带正电荷数相等列:n(H+)×1-0.08 mol×1-0.2 mol×2=0.08 mol×2,得n(H+)=0.64 mol。(4)根据反应的物质的量之比等于化学计量数之比,配平的离子方程式为:(4) 5R2O42- + 2MnO4- +16 H+ = 10RO2 + 2Mn2+ + 8 H2O。
考点:考查氧化还原反应的计算。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2015届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列变化中,需加入氧化剂才能实现的是
A.HCl → H2 B.H2O2 → O2 C.SO2 → SO3 D.FeCl3 → FeCl2
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-===AlO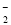 +2H2O
+2H2O
B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+=I2+2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>C>B>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
下列有关分类的说法正确的是
A.天然气、水力、电能都是一级能源
B.聚乙烯、聚氯乙烯、纤维素都属于合成高分子
C.明矾、石膏、冰醋酸、水都是电解质
D.液化、汽化、升华、风化等都是物理变化过程
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:推断题
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
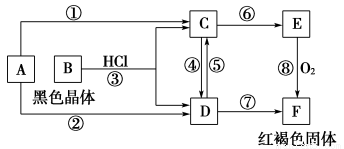
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________。
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.族序数等于其周期序数的元素一定是金属元素
B.13C与14C互为同位素,它们的化学性质相同,但相对原子质量不同
C.元素原子的最外层电子数等于元素的最高化合价
D.全部由非金属元素组成的化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:实验题
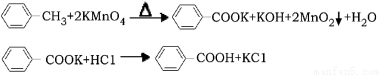
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
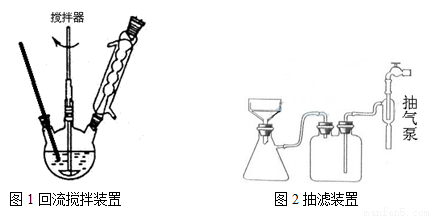
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
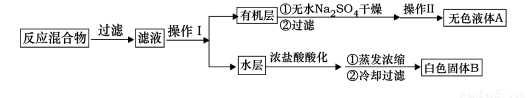
(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:填空题
(12分). A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com