

���� ��1�����ǻ������ֽ���������b�����ǻ���������������������
��2��a��b��һ��˫��������һ�������Ͷȣ�
��3��a����ȥ��Ӧ���������֣� ��
��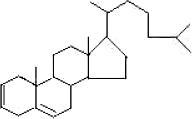 ��
�� ���尴1��1�����ӳ�ʱ�����Էֱ�������˫���Ϸ���1��2�ӳɣ����ܷ���1��4�ӳɣ�
���尴1��1�����ӳ�ʱ�����Էֱ�������˫���Ϸ���1��2�ӳɣ����ܷ���1��4�ӳɣ� ���尴1��1�����ӳ�ʱ����������˫���Ϸֱ����ӳɣ��ݴ˷�����
���尴1��1�����ӳ�ʱ����������˫���Ϸֱ����ӳɣ��ݴ˷�����
��� �⣺��1�����ǻ������ֽ�������b�����ǻ�����������������b����Ϊ���飬��ѡA��
��2��a��b��һ��˫��������һ�������Ͷȣ���a��b������2����ԭ�ӣ��ʴ�Ϊ��2��
��3��a����ȥ��Ӧ���������֣� ��
�� ��
�� ���尴1��1�����ӳ�ʱ�����Էֱ�������˫���Ϸ���1��2�ӳɣ�����Ϊ��
���尴1��1�����ӳ�ʱ�����Էֱ�������˫���Ϸ���1��2�ӳɣ�����Ϊ��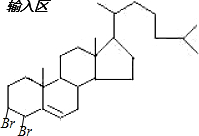 ��
��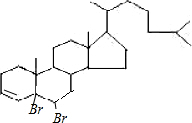 �����ܷ���1��4�ӳɣ�����Ϊ��
�����ܷ���1��4�ӳɣ�����Ϊ��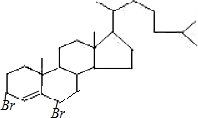 ��
�� ���尴1��1�����ӳ�ʱ����������˫���Ϸֱ����ӳɣ�����Ϊ��
���尴1��1�����ӳ�ʱ����������˫���Ϸֱ����ӳɣ�����Ϊ�� ��
�� ������5�ֲ���ʴ�Ϊ��5��
������5�ֲ���ʴ�Ϊ��5��
���� ���⿼�����л������������ȥ����Ľṹ����������˫������ļӳɷ�Ӧ��Ӧע���ϩ����1��2�ӳɺ�1��4�ӳɲ������д��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2 | B�� | NaCl | C�� | K2CO3 | D�� | Al |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡ����������������Һǡ���кͣ�Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| B�� | ���0.1 mol/L��ˮ��c��OH-��Ϊ10-3 mol•L-1��NH3•H2O?NH4++OH- | |
| C�� | ��ƫ��������Һ��ͨ�����CO2���ְ�ɫ������2AlO2-+CO2+3H2O�T2Al��OH��3��+CO32- | |
| D�� | ̼��������Һ�����ʯ��ˮ��ϳ��ְ�ɫ������2HCO3-+Ca2++2OH-�TCaCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BeF2�����У�����ԭ��Be�ļ۲���Ӷ���Ϊ2���Ҽ����Ӷ���Ҳ����2���ռ乹��Ϊֱ���� | |
| B�� | SF2�����У�����ԭ��S�ļ۲���Ӷ�������4����VSEPRģ��Ϊ�����壬�������幹��ΪV�� | |
| C�� | BF3���ӵ����幹��Ϊƽ���������� | |
| D�� | CO32-���ӵ�����ԭ�Ӳ�ȡsp3�ӻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg+2HCl�TMgCl2+H2�� | B�� | 2Na2O2+2H2O�T4NaOH+O2�� | ||
| C�� | NaH+H2O�TNaOH+H2�� | D�� | 2H2O2�T2H2O+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | 1 | 2 | 3 | 4 | 5 | 6 |
| c��HI��/ml•L-1 | 0.100 | 0.200 | 0.150 | 0.100 | �� | 0.500 |
| c��H2O2��/ml•L-1 | 0.100 | 0.100 | 0.150 | 0.200 | �� | 0.400 |
| ��/ml•L-1•s-1 | 0.0076 | 0.0152 | 0.0171 | 0.0152 | 0.0228 | 0.152 |
| A�� | 0.150ml•L-1��0.200ml•L-1 | B�� | 0.300ml•L-1��0.100ml•L-1 | ||
| C�� | 0.200ml•L-1��0.200ml•L-1 | D�� | 0.100ml•L-1��0.300ml•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����ͭ | B�� | �� | C�� | ���嵪 | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ʼŨ�� | �� | �� | �� |
| c��H2��mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��mol/L | 0.010 | 0.010 | 0.020 |
| A�� | ƽ��ʱ�����кͱ���H2��ת���ʾ���60% | |
| B�� | ƽ��ʱ������c��CO2����0.012 mol/L | |
| C�� | ƽ��ʱ������CO2��ת���ʴ���60% | |
| D�� | ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| ���� ��� | ��ʼʱ���������ʵ���/mol | ��ƽ��ʱ��ϵ�� �����仯 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | ����23.1kJ |
| b | 0.6 | 1.8 | 0.8 | ����Q kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com