

分析 用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4•2H2O):粉碎后用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有CoSO4、NiSO4、FeSO4、Al2(SO4)3及过量的硫酸,滤渣Ⅰ为SiO2,滤液中加入过氧化氢和CoO,将Fe2+氧化为Fe3+,同时调节pH,使铁离子、铝离子转化为沉淀除去,所以滤渣Ⅱ为氢氧化铁、氢氧化铝,向滤液中加入RH,Ni 2+,溶于有机层,为分液,向水层加入(NH4)2C2O4,得到草酸钴晶体,据此分析解答(1)~(4);
(5)根据原子守恒和化合价代数和为0计算;
(6)高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高.
解答 解:(1)用含钴废料,粉碎后用硫酸溶解,SiO2不与硫酸反应,滤渣Ⅰ为SiO2,提高硫酸的浓度、提高反应的温度、搅拌能提高酸浸速率;
故答案为:SiO2;提高硫酸的浓度、提高反应的温度、搅拌;
(2)通过操作①得到水层和有机层,则操作①为分液,分液需要的仪器有:分液漏斗、烧杯;
故答案为:分液漏斗、烧杯;
(3)H2O2氧化亚铁离子生成铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)加入氧化钴的目的是调节溶液的pH,使铁离子铝离子沉淀;
故答案为:调节溶液pH;
(5)取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,则n(Cl)=0.28L×5mol/L=1.4mol,有得到CoCl2溶液和2.24L(标准状况)黄绿色气体,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,故n(CoCl2)=0.6mol,则n(Co原子)总=0.6mol,
由电子守恒:Cl2~2e-~2Co3+,则n(Co3+)=2n(Cl2)=0.2mol,
所以固体中的n(Co2+)=0.6mol-0.2mol=0.4mol,
根据化合价为0,氧化物中n(O)=(0.2mol×3+0.4mol×2)÷2=0.7mol,
故该钴氧化物中n(Co):n(O)=0.6mol:0.7mol=6:7;
故答案为:6:7;
(6)用酸性KMnO4标准液滴定草酸根离子(C2O42-),发生氧化还原反应,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O,KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O;偏高.
点评 本题物质制备的工艺流程,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀有气体、尿素、冰水混合物 | B. | 乙醇、浓硫酸、胆矾 | ||
| C. | 金刚石、铁矿石、大理石 | D. | 水银、水蒸气、生铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
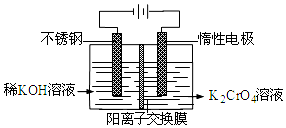
| A. | 在阴极式,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 铬原子的价电子排布式为3d44S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两次平衡时,C(g)的浓度相等 | |
| B. | 平衡时,单位时间内n(B)生成:n(C)消耗=1:1 | |
| C. | 若再向平衡体系中加入少量A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
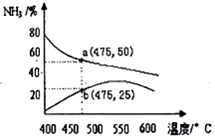 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
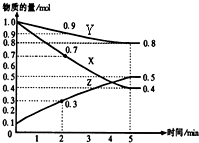 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、Al(NO3)3 | B. | BaCO3、MgCl2 | C. | MgSO4、AlCl3 | D. | Ba(NO3)2、Mg(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生水合过程,并且放出热量 | |
| B. | 发生扩散过程,并且放出热量 | |
| C. | 水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 扩散过程放出的热量大于水合过程吸收的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com