
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
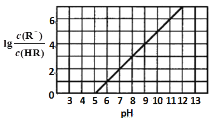
A.0.1mol·L-1HR溶液的pH为5
B.当pH=6时,水电离出的氢离子浓度为1.0×10-6
C.当通入0.1 mol NH3时,c(![]() )>c(R-)>c(H+)>c(OH-)
)>c(R-)>c(H+)>c(OH-)
D.当 pH=7时,c(![]() )=c(R-)
)=c(R-)
【答案】D
【解析】
A.据图可知lg![]() =0时,溶液pH=5,lg
=0时,溶液pH=5,lg![]() =0,则
=0,则![]() =1,所以此时Ka=
=1,所以此时Ka= =c(H+) =10-5;设0.1mol·L-1HR溶液中c(H+) =a,则有
=c(H+) =10-5;设0.1mol·L-1HR溶液中c(H+) =a,则有![]() ,解得a约为10-3mol/L,所以溶液pH为3,故A错误;
,解得a约为10-3mol/L,所以溶液pH为3,故A错误;
B.pH等于6时溶液中的溶质为NH4R和HR,此时水的电离受到抑制,溶液中的c(H+) =10-6 mol/L,但不是全部由水电离,溶液中c(OHˉ) =10-8 mol/L,且全部由水电离,而水电离出的氢离子和氢氧根相等,所以水电离出的氢离子浓度约为10-8 mol/L,故B错误;
C.1L0.1mol·L-1HR溶液中n(HR)=0.1mol,所以当通入0.1 mol NH3时,溶液中的溶质为NH4R,Rˉ水解使溶液显碱性,铵根水解使溶液显酸性,根据题意可知常温下NH3·H2O电离平衡常数K=1.76×10-5> Ka(HR),一水合氨的电离程度更大,所以Rˉ的水解程度更大,所以溶液显碱性,则c(OH-)>c(H+),故C错误;
D.当 pH=7时,溶液中c(OH-)=c(H+),结合电荷守恒:c(H+)+c(![]() )=c(R-)+ c(OH-)可知c(
)=c(R-)+ c(OH-)可知c(![]() )=c(R-),故D正确;
)=c(R-),故D正确;
故答案为D。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
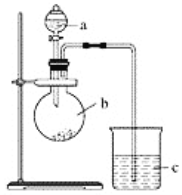
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯中的溶液为2 mol·L-1CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )

A.加入固体NaOHB.加水稀释C.加入金属NaD.通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域。以下为镁的两种冶炼方法。
Ⅰ.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3·MgCO3)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO·MgO),然后在还原炉中经1 200 ℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示。
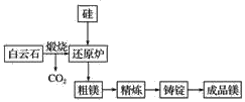
(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式:_______________。
Ⅱ.海水综合利用可以制备金属镁,其流程如下图所示:
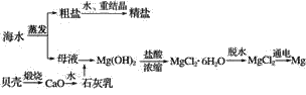
(2)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是___________________________。
(3)综合比较两种方法,皮江法的缺点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 304 | 670 |
沸点/℃ | 132 | 173 | 316,易升华 | 700 |
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原少量无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为B→A→___→___→___→E(填字母,装置可多次使用);A中长颈漏斗的作用_____________。
③C中盛放的试剂是_____________。
(2)利用反应2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
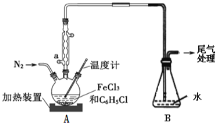
①仪器a的作用是__________。
②反应中提供过量氯苯的作用是__________。
③反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250 mL,量取25.00 mL所配溶液,用0.400 mol/L的NaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(
2NH3(g)△H=-92.4 kJ·mol-1。N2的平衡转化率(![]() )与体系总压强(P)的关系如右图所示。下列说法正确的是( )
)与体系总压强(P)的关系如右图所示。下列说法正确的是( )
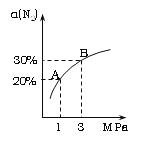
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁条在空气中燃烧时,镁可与空气中的一种主要成分反应,生成少量的物质A,已知A有下面一系列变化。气体C能够使湿润的红色石蕊试纸变蓝。
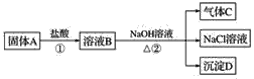
(1)写出A、C、D的化学式:
A________;C________;D________。
(2)写出下列反应的化学方程式:
①______________________________________________;
②____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)钠在氯气中燃烧___;
(2)铝与硫蒸气反应___;
(3)铁在氯气中燃烧___;
(4)铁与硫蒸气反应___;
(5)铜在氯气中燃烧___;
(6)铜与硫蒸气反应___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com