
���� ��1������NaOH��Һ��NaOH��H+��Ӧ����ƽ�������ƶ���
��2�������NaOH��Һ�ģ�l�����ټ������ϡH2SO4��c��H+������ƽ�������ƶ���
��3����ԭ��Һ�м���Ba��NO3��2��Һ�����ɻ�ɫ����BaCrO4��ƽ�������ƶ���
��4��Ҫʹ������Һ��ɫ���Ӧ��ʹc��CrO42-������
��5����0.05mo1K2Cr2O7���Ƴ�1L K2CrO4��Һ������CrO42-��Ũ��С��10-5mol/L��������ʱ��K2Cr2O7��H2O�⣬����Ҫ�������ʴٽ�Cr2O72-ˮ���Ҳ��������µ����ʣ�����ʱ���õ��IJ����������ձ���������֮�Ҫ1000mL����ƿ����ͷ�ιܣ�
��� �⣺��1������NaOH��Һ��NaOH��H+��Ӧ����c��H+����С��ƽ�������ƶ�����Һ�ʻ�ɫ��
�ʴ�Ϊ���ƣ�NaOH��H+��Ӧ����c��H+����С��ƽ�������ƶ���
��2�������NaOH��Һ�ģ�l�����ټ������ϡH2SO4��c��H+������ƽ�������ƶ�����Һ�ʳ�ɫ���ʴ�Ϊ���ȣ�c��H+������ƽ�������ƶ���
��3����ԭ��Һ�м���Ba��NO3��2��Һ�����ɻ�ɫ����BaCrO4��c��CrO42-����С��ƽ�������ƶ�����Һ��ɫ��dz���ʴ�Ϊ�������ƶ�����dz��
��4��Ҫʹ������Һ��ɫ���Ӧ��ʹc��CrO42-�������Լ����Һ�������¶ȵȷ���ʵ�֣�
�ʴ�Ϊ�������Һ�������¶ȣ�
��5����0.05mo1K2Cr2O7���Ƴ�1L K2CrO4��Һ������CrO42-��Ũ��С��10-5mol/L��������ʱ��K2Cr2O7��H2O�⣬����Ҫ�������ʴٽ�Cr2O72-ˮ���Ҳ��������µ����ʣ�Ӧ�ü���KOH��Һ������ʱ���õ��IJ����������ձ���������֮�Ҫ1000mL����ƿ����ͷ�ιܣ�1000mL����ƿ������Һ����ͷ�ιܶ��ݣ�
�ʴ�Ϊ��KOH��Һ��1000mL����ƿ����ͷ�ιܣ�
���� ���⿼����������Ի�ѧƽ���ƶ�Ӱ�죬Ϊ��Ƶ���㣬���ؿ���ѧ�������ж���������������������ӵ����ʴٽ�ˮ�⡢�����������������ͬ����������ˮ�⣬��Ŀ�ѶȲ���


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ѹǿ����ʱ��仯 | B�� | ��ѧ��Ӧ���ʹ�ϵ�ǣ�2������X��=������Y�� | ||
| C�� | �����������ܶȲ���ʱ��仯 | D�� | ������X��Y��Z��Ũ��֮��Ϊl��2��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
| �� | 387 | 0.20 | x | |
| �� | 387 | 0.40 | y | |
| �� | 207 | 0.20 | 0.090 | 0.090 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
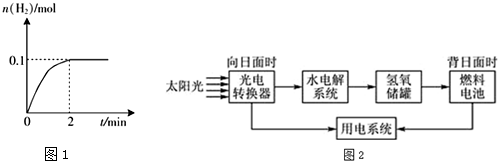
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �淴Ӧ������������Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ� | |
| B�� | �淴Ӧ���ʼ�С������Ӧ��������ƽ��������Ӧ�����ƶ� | |
| C�� | �����淴Ӧ���ʶ�����ƽ��������Ӧ�����ƶ� | |
| D�� | �����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
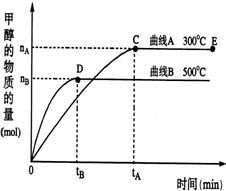 һ�������£������Ϊ2L���ܱ������У�һ����̼�������ڴ������÷�Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g������������������и��⣺
һ�������£������Ϊ2L���ܱ������У�һ����̼�������ڴ������÷�Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g������������������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol/L�ģ�NH4��2SO4��Һ��c��SO42-����c��NH4+����c��H+����c��OH-�� | |
| B�� | 0.1 mol/L��NaHCO3��Һ��c��Na+��=c��HCO3-��+c��H2CO3��+2c��CO32-�� | |
| C�� | ��0.2 mol/L NaA��Һ��0.1 mol/L�����������������Һ��c��Na+��+c��H+��=c��A-��+c��Cl-�� | |
| D�� | 0.02mol/L CH3COOH��Һ��0.01 mol/L NaOH��Һ��������������Һ��2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com