
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫OH-+SO2=HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+=Fe(OH)3↓+3NH4+ |
分析 A.反应生成碳酸氢钙、HClO;
B.电子、电荷不守恒;
C.反应生成亚硫酸铵;
D.反应生成氢氧化铁、氯化铵.
解答 解:A.次氯酸钙溶液中通入过量的二氧化碳的离子反应为ClO-+H2O+CO2=HCO3-+HClO,故A错误;
B.硫酸亚铁溶液中加入过氧化氢溶液的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,故B错误;
C.用氨水吸收少量二氧化硫的离子反应为2NH3.H2O+SO2=2NH4++SO32-+H2O,故C错误;
D.硝酸铁溶液加入过量氨水的离子反应为3NH3•H2O+Fe3+=Fe(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:实验题
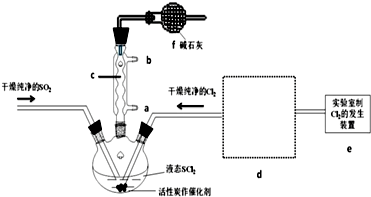
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 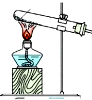 | 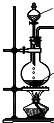 | 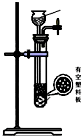 | 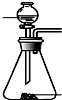 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4 | 4mol/LHNO3+NaHSO3 | 70%NaHSO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
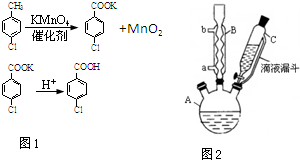 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
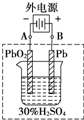 铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量( mol•L -1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
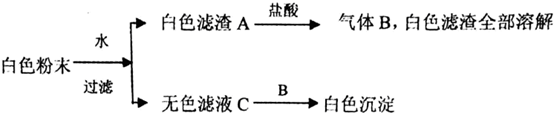
| A. | BaCl2,CaCO3一定存在,NaOH可能存在 | |
| B. | K2SO4、CuSO4一定不存在 | |
| C. | K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在 | |
| D. | C为单一溶质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液:K+、Na+、F-、Br- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com