
| A. | 氯化氢气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热氯酸钾使其分解 | D. | 氯化钠熔融 |
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 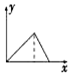 | B. | 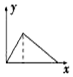 | C. | 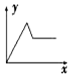 | D. | 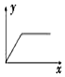 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LL任何气体都约含NA个气体分子 | |
| B. | 标准状况下,1mol液溴的体积约为22.4L | |
| C. | 1mol铁与足量盐酸反应,转移电子数为3NA | |
| D. | 18gNH4+中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K |
| HX | 9×10-7 |
| HY | 9×10-6 |
| HZ | 1×10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y -=HY+Z -能够发生 | |
| C. | 相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 | |
| D. | 相同温度下,1mol/L HX溶液的电离常数大于0.1mol/L HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2CO2═2Na2CO3+O2,所以2Na2O2+2SO2═2Na2SO3+O2 | |
| B. | 电解熔融NaCl可以得到单质钠,所以电解熔融AlCl3也能得到单质铝 | |
| C. | CH4的空间构型是正四面体,所以CH3Cl的空间构型也是正四面体 | |
| D. | H2S的沸点比H2O低.所以PH3的沸点也比NH3低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com