
 2Fe+Al2O3,为重要的铝热反应,过氧化钠为离子化合物,化合物中含有过氧键,电子式为:
2Fe+Al2O3,为重要的铝热反应,过氧化钠为离子化合物,化合物中含有过氧键,电子式为: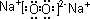 ,故答案为:铝热反应;
,故答案为:铝热反应; ;
;

科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
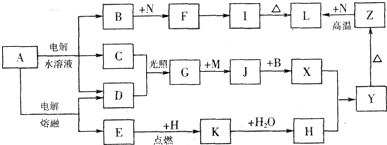
图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:

(1)工业上,在电解A溶液的设备中将阴极区和阳极区用隔开,目的是 。
(2)Z→L反应的名称是 ,K的电子式为 。
(3)写出B→F的离子方程式 。
(4)写出K与C02反应的化学方程式 。
(5)Y与NaCl0和B混合溶液作用,是制备绿色水处理剂(Na2M04)的一种方法,请写出有关反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1)Z→L反应的名称是 。
(2)K的电子式为 。
(3)写出B→F的离子方程式 。
(4)写出K与CO2反应的化学方程式 。
(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:09-10年建湖二中高二下学期期末考试化学卷 题型:填空题
(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:

(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com