
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,22.4 L乙烯中含C﹣H键的数目为4NA
B.1molFe与足量盐酸反应转移电子数为3NA
C.1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA
D.向1L 1 molL﹣1氯化铝溶液中加入足量的氨水,生成AlO2﹣的个数为NA
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
C.0.2mol?L﹣1 CH3COOH溶液与0.1mol?L﹣1 NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
D.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热的浓HNO3能使蓝色石蕊试纸先变红后褪色
B.用HNO3和Na2S反应可以制得H2S气体
C.浓硫酸使蔗糖炭化,体现浓硫酸的的吸水性
D.热的浓硫酸可以用铁制器皿贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
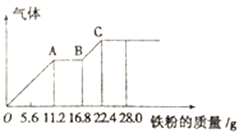
A. 原混合酸液中NO3-的物质的量为0.4mol B. AB段反应为2Fe3++Fe=3Fe2+
C. 溶液中最终溶质为FeSO4 D. c(H2SO4)为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分散质微粒直径的大小关系:溶液>胶体>浊液
B. 利用丁达尔效应可以区别溶液与胶体
C. 胶体粒子比较小,可以通过半透膜
D. 电泳现象可证明胶体属于电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
A. SO42- B. Cl- C. OH- D. CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
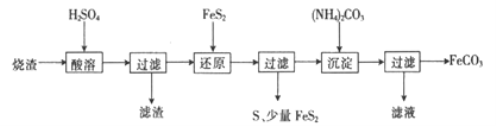
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。干燥的氯气与碘反应可以制备ICl ,请用下列装置来制备ICl。

回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B 中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
(4)将D装置得到的液态产物进步提纯可得到较纯净的IC1,提纯采取的方法是___________。
(5)ICl 与冷的NaOH稀溶液反应的离子方程式为______________。
(6)请设计实验证明IC1的氧化性比I2强:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com