
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
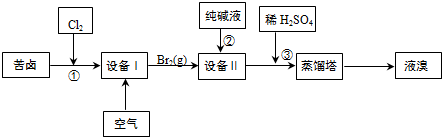
分析 (1)由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在设备Ⅱ吸收塔中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,加入稀硫酸③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,以此来解答.
①吸收3molBr2时,其中1mol溴原子从0→+5,5mol溴原子从0变为-1,据此计算转移电子数;
②在设备Ⅰ吹出塔中用空气吹出Br2,并在设备Ⅱ吸收塔中用纯碱溶液吸收;
③依据题干叙述可知溴酸根离子和溴离子在酸性条件下发生价态归中反应;
④温度过高会导致水蒸气蒸发出来,温度过低无法将溴蒸发出来;
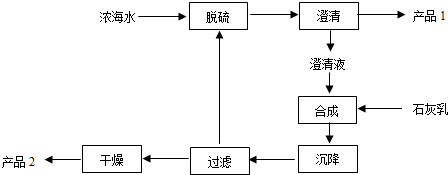
(2)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量;
(3)混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺.
解答 解:(1)①在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,吸收3molBr2时,其中1mol溴原子从0→+5,5mol溴原子从0变为-1,转移电子数为:5mol,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
②设备Ⅰ为利用空气将吹出塔中含Br2的溶液,所以设备I为吹出塔,在设备Ⅱ中吸收溶液中含有的BrO3-,所以设备II为吸收塔,
故答案为:B;A;
③溴酸根离子和溴离子在酸性条件下发生价态归中反应,BrO3-由正五价降为0价;还原剂是化合价升高的物质,Br-由正五价升为0价,其离子反应方程式为:BrO3-+5Br-+6H+=3Br2+3H2O,
故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
④温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏的原因是顺利将溴蒸出,同时防止水馏出,
故答案为:顺利将溴蒸出,同时防止水馏出;
(2)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2+(aq)+Ca(OH)2(s)=Mg(OH)2(s)+Ca2+ (aq),合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,溶液中m(Mg2+)=1L×28.8g/L=28.8g;
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:CaSO4;69.6;
(3)①混凝法是加入一种混凝剂(如:明矾、铁盐等),使水中细小的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,海水中可溶性杂质不能除去,不能进行海水淡化,故①错误;
②改进工艺,尽可能减少新物质引入,除去粗产品中的杂质,可以提高产品的质量,故②正确;
③海洋是一个远未完全开发的巨大化学资源宝库,海水中元素种类很多,改进工艺可以优化提取产品的品种,故③正确;
④根据不同的提取原理可以改进钾、溴、镁等的提取工艺,从而提高K、Br2、Mg等的提取质量,故④正确;
故选:②③④.
点评 本题考查海水的综合利用、纯碱制备的工业原理、从海水中提溴、镁的流程等知识,题目难度中等,明确生成流程为解本题关键.


科目:高中化学 来源: 题型:选择题
| A. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| B. | 在食品中大量添加苯甲酸钠等防腐剂,延长其保质期 | |
| C. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| D. | 将聚氯乙烯制成食品保鲜膜和包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
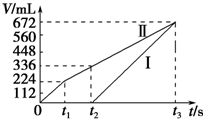 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
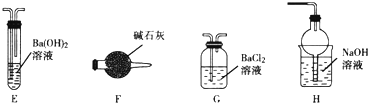
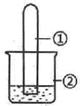 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
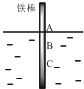 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )| A. | 该腐蚀过程属于电化腐蚀 | |
| B. | 铁棒AB段电极反应为O2+2H2O+4e→4OH- | |
| C. | 铁棒AB段是负极,BC段是正极 | |
| D. | 产生此现象的根本原因是铁棒所处化学环境的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
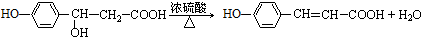 .
.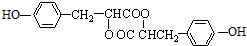 .
.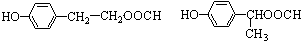 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com