
【题目】A、B两种元素为同一周期ⅡA和ⅢA元素,若A元素的原子序数为x,则B元素的原子序数可能为( )
①x+1 ②x+21 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.①③B.②④C.①③⑤D.②④⑥
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工.作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。同时利用此装置的电能在铁上镀铜,下列说法不正确的是
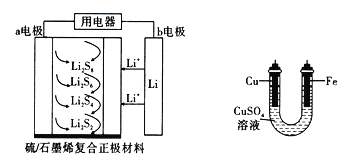
A. 电池工作时,a是正极,外电路中流过0.02mol电子,负极材料减重0.14g
B. 石墨烯的作用主要是提高电极a的导电性
C. 当钾硫电池电极提供1mol电子时,则理论上铁电极增重32g
D. 放电时,Li+向正极移动,在此电池中加人硫酸可增加导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )
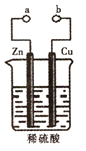
A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.
【题型】综合题
【结束】
25
【题目】(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________.
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。

②由图可得Fe(OH)2的溶度积的值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图表示的是pH对植物和人的淀粉酶活性的影响;乙图表示的是3种脱氢酶(A、B、C)的活性受温度影响的情况。下列叙述正确的是( )

A. 从甲图中可以知道pH=6时植物淀粉酶的活性最高
B. 从乙图中无法知道酶C的最适温度
C. 从甲图中可以知道若细胞由酸性变成碱性时,淀粉酶的活性逐渐升高
D. 从乙图中可以知道酶活性温度范围最广的是B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种物质:①苯、②聚氯乙烯、③丙烯、④对﹣二甲苯、⑤1﹣丁炔,既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应使之褪色的是
A. ②③ B. ①④ C. ③⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中物质,能用分液漏斗直接进行分离的是
A. 鸡蛋清溶液中加入饱和硫酸钠溶液
B. 乙酸乙酯和饱和碳酸钠溶液
C. 乙酸和乙醇
D. 甘油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.钠保存在石蜡油或煤油中
B.实验室盛装NaOH溶液的试剂瓶用玻璃塞
C.保存FeSO4溶液需加入少量铁粉
D.氯水保存在棕色试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com