
 .
. →
→ .
.分析 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同主族,B和D同主族,C+和B3-具有相同的电子层结构,则C位于第三周期、B位于第二周期,C为Na、B为N元素;A和C同主族,B和D同主族,则A为H元素、D为P元素;A和B形成的化合物为氨气,氨气在水中呈碱性,满足条件;C和E形成的原子个数为1:1的化合物,是人们生活的必需品,该化合物为NaCl,则E为Cl元素;H和N、P、Cl均能形成共价型化合物,也满足条件,据此进行解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同主族,B和D同主族,C+和B3-具有相同的电子层结构,则C位于第三周期、B位于第二周期,C为Na、B为N元素;A和C同主族,B和D同主族,则A为H元素、D为P元素;A和B形成的化合物为氨气,氨气在水中呈碱性,满足条件;C和E形成的原子个数为1:1的化合物,是人们生活的必需品,该化合物为NaCl,则E为Cl元素;通过验证,H和N、P、Cl均能形成共价型化合物,满足要求,
(1)五种元素中,原子半径最大的为Na元素;非金属性最强的为Cl元素,
故答案为:Na;Cl;
(2)由A和D形成的化合物为PH3,A和E所形成的化合物为HCl,非金属性Cl>P,则热稳定性:PH3>HCl,
故答案为:PH3(写成H3P也给分);
(3)A和E形成的化合物HCl,A和B形成的化合物NH3,二者反应生成NH4Cl,氯化铵为离子化合物,其电子式为 ,
,
故答案为: ;
;
(4)氨气为共价化合物,用电子式表示其形成过程为3H•+ →
→ ,
,
故答案为:3H•+ →
→ ;
;
(5)非金属性越强,最高价氧化物对应水合物的酸性越强,非金属性:Cl>N>P,则酸性最强的是高氯酸,分子式为:HClO4,
故答案为:HClO4;
(6)将少量E(Cl2)的单质通入足量碘化亚铁溶液中,二者发生氧化还原反应,反应的离子方程式为:2I-+Cl2═I2+2Cl-,
故答案为:2I-+Cl2═I2+2Cl-.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
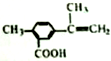 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 仅考虑取代基在苯环上的位置变化,M的同分异构体有9种 | |
| C. | 该有机物的碳原子一定处于同一平面 | |
| D. | 该有机物一定条件下只能发生加成反应和酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
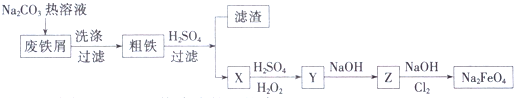
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
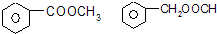 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CO2属于分子晶体 | |
| B. | CO2和CH4分子中含有极性共价键,但都是非极性分子 | |
| C. | 因为碳氢键键能小于碳氧双键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: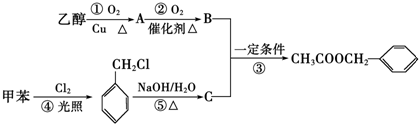
 .
. ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com