
| A. | 0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA | |
| B. | 2.24 L二氧化碳中含有共价键数目为4NA | |
| C. | 7.1g Cl2与足量NaOH 溶液反应转移的电子数为0.2NA | |
| D. | 1 mol NH4+中含有电子数为10 NA |
分析 A.溶液体积未知;
B.气体状况未知;
C.氯气与氢氧化钠反应为歧化反应;
D.一个铵根离子含有10个电子.
解答 解:A.依据n=CV可知,溶液体积未知,无法计算硫酸根离子数目,故A错误;
B.气体状况未知,Vm未知,无法计算二氧化碳物质的量和含有共价键数目,故B错误;
C.7.1g Cl2物质的量为$\frac{7.1g}{71g/mol}$=0.1mol,与足量NaOH 溶液反应生成氯化钠和次氯酸钠和水,转移的电子数为0.1NA,故C错误;
D.一个铵根离子含有10个电子,则1 mol NH4+中含有电子数为10 NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积概念的分析和条件应用,物质结构的理解掌握和氧化还原反应电子转移计算,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Al2O3和 MgO 的熔点均很高,可用于制作耐高温材料 | |
| B. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 | |
| B. | 将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 | |
| C. | 生活、生成中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 | |
| D. | 垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 |
| A. | 该反应所需的仪器有:量筒、温度计、秒表、烧杯 | |
| B. | 通过记录产生淡黄色沉淀所需的时间可以比较反应的快慢 | |
| C. | 比实验 II、III研究温度对该反应速率的影响,则y=0.2 | |
| D. | 对比实验 I、II研究C(H+)对该反应速率的影响,则x=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可用于治疗胃酸过多 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 铝制容器可以贮运浓硝酸 | D. | 过氧化钠可用作潜水艇供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所消耗的氧气分子数为3NA | |
| D. | 1molCH5+离子所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
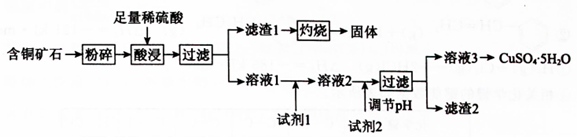
| 试剂 | 成分 | 价格/(元•吨-1) |
| 漂液 | 含25.2% NaClO | 450 |
| 双氧水 | 含30% H2O2 | 2400 |
| 浓硝酸 | 含98% HNO3 | 1500 |
| 氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2、Br2、Cl2 | B. | Na+、K+、Cs+ | C. | Cl-、Br-、I- | D. | Al3+、Mg2+、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com