
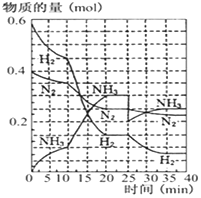
 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.分析 (1)图中分析可知10min内氨气物质的量增加0.1mol,反应速率v=$\frac{△c}{△t}$;
(2)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂或增大压强;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)图中分析可知10min内氨气物质的量增加0.1mol,10分钟内用氨气表示该反应的平均速率,V(NH3)=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol/(Lmin),
故答案为:0.005mol/(Lmin);
(2)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小容器体积压强增大,反应速率增大,降低温度反应速率减小,增加NH3物质的量氨气物质的量应增大不连续,故选AB,
故答案为:AB;
(2)反应N2(g)+3H2(g)=2NH3
A.速率之比等于化学方程式计量数之比为正反应速率之比,2v正(H2)=3v逆(NH3)说明氨气正逆反应速率相同,但3v正(H2)=2v逆(NH3)不能说明反应达到平衡状态,故A错误;
B.混合气体的质量不变,体积不变,密度始终不变,若密度不再随时间变化,不能说明平衡,故B错误;
C.容器内前后气体的物质的量有变化,说明压强时变量,总压强不再随时间而变化,说明平衡,故C正确;
D.N2、H2、NH3的分子数之比为1:3:2任何时刻都成立,故D错误;
E.单位时间生成m mol N2的同时生成3m mol H2,方向逆向进行,故E错误;
F.a mol N≡N键断裂的同时,有6a mol N-H键形成,方向相同,不能作为平衡的判断,故F错误;
故答案为:C.
点评 本题考查化学反应速率、化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com