
【题目】已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取四个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4∶1)的混合气体、二氧化氮和氧气(体积比为4∶3)的混合气体;然后分别做溶解于水的喷泉实验。实验结束后四个烧瓶中所得溶液的物质的量浓度之比为 ( )
A. 2∶1∶2∶2 B. 5∶5∶5∶4
C. 5∶5∶4∶4 D. 7∶7∶4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )

A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )

A. 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L
B. b极的电极反应式为:O2+2H2O+4e-=4OH-
C. 工作一段时间后,电解质溶液碱性减弱
D. 该装置将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
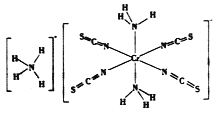
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
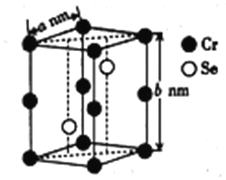
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.炒过菜的铁锅为及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢“或“吸氧”)。
(2)写出铁锅腐蚀时正极的电极反应式: 。
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com