
| A. | 25℃时,1 LpH=l的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数目为2 NA | |
| C. | 向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NA | |
| D. | 向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA |
分析 A.25℃时,pH=l的硫酸溶液中,氢离子浓度为0.1mol/L,依据N=CVNA计算氢离子个数;
B.过氧化钠与水反应为歧化反应,过氧化钠既做氧化剂又做还原剂;
C.依据电荷守恒判断;
D.硅酸胶体微粒为多个硅酸胶体分子的集合体.
解答 解:A.25℃时,pH=l的硫酸溶液中,氢离子浓度为0.1mol/L,则1L溶液中含有氢离子个数为:0.1mol/L×1L×NA=0.1NA,故A错误;
B.过氧化钠与水反应为歧化反应,过氧化钠既做氧化剂又做还原剂,1 mol Na2O2与水完全反应时转移电子数目为1NA,故B错误;
C溶液存在电荷守恒:n(Cl-)+n(OH-)=n(NH4+)+n(H+),溶液呈中性,n(H+)=n(OH-),所以n(Cl-)=n(NH4+)=1 mol,个数为NA,故C正确;
D.硅酸胶体微粒为多个硅酸胶体分子的集合体,所以向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目远远小于0.001 NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,熟悉以物质的量为核心计算公式是解题关键,注意过氧化钠与反应为歧化反应特点,注意溶液中电荷守恒的应用,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
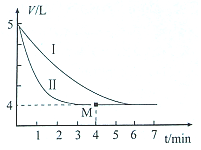 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
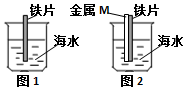
| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
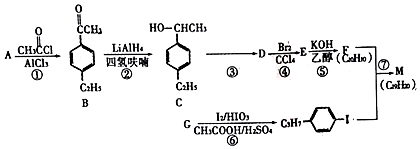
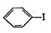 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
=C+H,回答下列问题: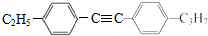 ,A的名称为乙苯.
,A的名称为乙苯. .
.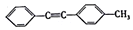 的合成路线:
的合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的一种单质具有良好的导电性 | |
| B. | 氧化物对应水化物的酸性:D>A | |
| C. | B、C的单质均可与NaOH溶液反应生成氢气 | |
| D. | A、B、C三种元素均可以与D元素形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
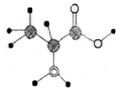 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com