
[化学——选修3: 物质结构与性质](15分)
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体。白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似。白锡的密度大于灰锡的密度。

(1)Sn元素价层电子排布式为 。
(2)SnCl2的一维链状聚合结构如图所示,在分子结构中标出
所含有的配位键。其固体分子及气体分子中Sn的杂化方式为 。
(3)SnCl4分子的空间构型为 ,SnCl4与CCl4中
沸点较高的是 。
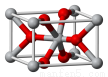
(4)锡的某种氧化物的晶胞如右图,其化学式为 。
(5)解释白锡分子的密度大于灰锡的密度的原因: 。
(6)若灰锡的晶胞边长为a pm,计算灰锡的密度 为 。
(1)5s25p2(2分)
(2) 图略 (2分) sp3、、 sp2 (各1分)
(3)正四面体;SnCl4(各1分)
(4)SnO2 (2分)
(5)配位数大,空间利用率大(2分)
(6)952/NA(a×10—10)3(3分)
【解析】
试题分析:(1)Sn元素是50号元素,最外层电子是4个,位于元素周期表的第五周期,第四主族,所以价层电子排布式为5s25p2;
(2)Sn元素的5p轨道上有空轨道,Cl原子中有孤对电子,所以1个SnCl2分子中的Sn与另一分子中的Cl原子可以形成配位键,从而形成一维链状聚合结构,配位键的形式是从提供孤对电子的一方指向提供空轨道的一方;固体分子SnCl2中存在一个配位键,所以Sn的价层电子对数是3+1/2(4-2×1)=4,所以是sp3杂化;气态时以单分子形式存在,所以Sn的价层电子对数是2+1/2(4-2×1)=3, sp2杂化;
(3)SnCl4分子中Sn的价层电子对数是4+1/2(4-4×1)=4,空间构型是正四面体型;SnCl4与CCl4都是分子晶体,所以相对分子质量大的分子间作用力大,沸点较高,所以SnCl4的沸点较高;
(4)锡的某种氧化物的晶胞中Sn原子8顶点各1个和中心1个,共是8×1/8+1=2个,O原子分别在上下2个底面各2个和体内的2个,共是4×1/2+2=4,所以Sn与O的原子个数比是2:4=1:2,化学式为SnO2
(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数是4,所以白锡晶体的配位数大,空间利用率大,单位体积拥有的Sn原子多,密度大;
(6)灰锡晶胞中Sn原子的个数是8,与金刚石晶胞中C原子个数相同,所以灰锡的密度=m/V=8×119/NA/(a×10-10)3=952/NA(a×10—10)3g/cm3
考点:考查原子结构、物质结构的判断,杂化轨道的判断,晶胞的计算


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是( )
A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种
B.质量数为16的一种核素在此容器中的原子百分数为85%
C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1
D.此容器中X2的平均分子量是34
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )

A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
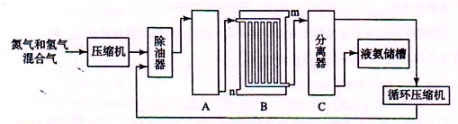
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3) 设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)  CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.256 g S8分子中含S-S键为7NA个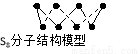
C.由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.15℃时氨基甲酸铵的分解平衡常数为2.048×10-9(mol/L)3
C.恒温下压缩体积,NH3的体积分数减小
D.再加入一定量氨基甲酸铵,可加快反应速率
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:简答题
[有机化学基础](15分)已知化合物G的合成路线如下:

(1)反应Ⅰ的反应类型为_____________,反应Ⅵ的反应类型为 。
(2)写出反应Ⅱ的化学方程式_____________________。写出反应Ⅲ的化学方程式____________。
(3)已知麦克尔反应:  ,反应Ⅵ属于上面列出的麦克尔反应类型,且F的核磁共振氢谱有两个吸收峰,面积比为3:1,则F的结构简式为 。
,反应Ⅵ属于上面列出的麦克尔反应类型,且F的核磁共振氢谱有两个吸收峰,面积比为3:1,则F的结构简式为 。
(4)写出检验C物质中官能团的方法和现象____________________________________。
(5)比G少2个氢原子的物质具有下列性质:
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗1mol NaOH; ④不考虑氧原子连接在一起的情况。
符合该要求的有机物有_______种,任写两种该物质的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于基本营养物质的说法中正确的是
A.糖类、油脂、蛋白质都是天然高分子化合物
B.蔗糖溶液加稀硫酸水浴后,再加入少量新制的Cu(OH)2加热可产生砖红色沉淀
C.利用油脂在碱性条件下水解,可以生产甘油和肥皂
D.浓硫酸可以使蛋白质变黄 ,称为颜色反应,常用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列过程没有发生化学反应的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com