
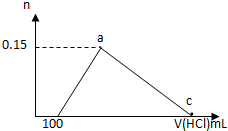
 在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )
在100mLAlCl3溶液中加入一定量的NaOH溶液,在反应后溶液中逐滴加入1mol/L盐酸,滴入盐酸的体积与产生沉淀的物质的量的关系如图所示,下列叙述正确的是( )| A. | 原AlCl3溶液的物质的量浓度为1.5mol/L | |
| B. | c点的体积为750mL | |
| C. | 原加入的NaOH的物质的量为0.7mol | |
| D. | a和c点间铝元素以AlO2-和Al(OH)3的形式存在 |
分析 根据图象可知,开始滴入盐酸时无沉淀生成,说明加入的NaOH溶液过量,反应后溶质为NaOH和NaAlO2;剩余的NaOH完全反应消耗了100mL 1mol/L的盐酸,则剩余氢氧化钠的物质的量为:n(NaOH)=n(HCl)=1mol/L×0.1L=0.1mol;沉淀达到最大量时,生成Al(OH)3的物质的量为0.15mol,根据Al原子守恒可知n(AlCl3)=n(NaAlO2)=n[Al(OH)3]=0.15mol,结合反应Al3++4OH-=AlO2-+2H2O可知铝离子消耗NaOH的物质的量为:n(NaOH)=4n(AlO2-)=0.15mol×4=0.6mol,所以原加入的NaOH的物质的量为:0.1mol+0.6mol=0.7mol;c点时溶质为NaCl,加入盐酸中含有HCl的物质的量为:n(HCl)=n(NaCl)=n(NaOH)=0.7mol,需要1mol/L的盐酸的体积为:$\frac{0.7mol}{1mol/L}$=0.7L=700mL;a、c之间铝元素以AlCl3和Al(OH)3的形式存在,据此进行解答.
解答 解:根据图象可知,开始滴入盐酸时无沉淀生成,说明加入的NaOH溶液过量,反应后溶质为NaOH和NaAlO2;剩余的NaOH完全反应消耗了100mL 1mol/L的盐酸,则剩余氢氧化钠的物质的量为:n(NaOH)=n(HCl)=1mol/L×0.1L=0.1mol;沉淀达到最大量时,生成Al(OH)3的物质的量为0.15mol,根据Al原子守恒可知n(AlCl3)=n(NaAlO2)=n[Al(OH)3]=0.15mol,结合反应Al3++4OH-=AlO2-+2H2O可知铝离子消耗NaOH的物质的量为:n(NaOH)=4n(AlO2-)=0.15mol×4=0.6mol,所以原加入的NaOH的物质的量为:0.1mol+0.6mol=0.7mol,
A.根据分析可知,原溶液中n(AlCl3)=n(NaAlO2)=n[Al(OH)3]=0.15mol,则c(AlCl3)=$\frac{0.15mol}{0.1L}$=1.5mol/L,故A正确;
B.c点沉淀达到最大量,此时溶质为NaCl,加入盐酸中含有HCl的物质的量为:n(HCl)=n(NaCl)=n(NaOH)=0.7mol,需要1mol/L的盐酸的体积为:$\frac{0.7mol}{1mol/L}$=0.7L=700mL,故B错误;
C.结合分析可知,加入NaOH的物质的量为0.7mol,故C正确;
D.c点铝离子完全转化成氢氧化铝沉淀,则a、c之间铝元素以AlCl3和Al(OH)3的形式存在,故D错误;
故选AC.
点评 本题考查了离子方程式的计算,题目难度中等,明确曲线变化与发生反应之间的关系为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脚气病 | B. | 坏血病 | C. | 夜盲症 | D. | 神经炎 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90mL容量瓶,7.2g | B. | 100mL容量瓶,8.0g | ||
| C. | 100mL容量瓶,7.2g | D. | 250mL容量瓶,20.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂和合成洗涤剂的结构相似,都含有憎水基和亲水基 | |
| B. | 肥皂不适用于硬水中洗涤,合成洗涤剂可以 | |
| C. | 合成洗涤剂难以被微生物分解,所以去污能力比肥皂好 | |
| D. | 肥皂的生产原料是油脂,成本高,合成洗涤剂的生产原料是石油副产品,成本较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:Fe2++Cl2=Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是澄清透明的 | B. | 胶体能产生丁达尔现象 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com