
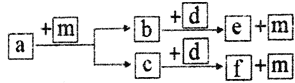
【题目】短周期元素W、X、Y、Z的原子序数依次递增, a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是
A. 简单离子半径:Z>Y
B. Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2∶1
C. 简单气态氢化物的热稳定性:Y>X
D. 由上述4种元素组成的化合物属于离子化合物
【答案】A
【解析】短周期元素W、X、Y、Z的原子序数依次递增, a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,为Na2O2,m为元素Y的单质,为O2,Y为O,有两种常见物质H2O、CO2能与Na2O2反应生成O2,W、X、Y、Z分别为H、C、O、Na四种元素,a、b、c、d、e、f可能为CH4(或其它烃或烃的含氧衍生物)、H2O或CO2、CO2或H2O、Na2O2、NaOH或Na2CO3或NaOH,m为O2。
A、Na+ 小于O2― ,电子层结构相同时,原子核电荷大的半径反而小,故A 错误;B、过氧化钠为离子化合物,离子晶体中既含有钠离子和过氧根离子形成的离子键,也会有O-O共价键,阳离子Na+ 和阴离子O22―的比值为2∶1,故B正确;C 、O―H的键能比C―H的键能大,简单气态氢化物的热稳定性:Y>X,故C正确;D、由上述4种元素组成的化合物NaHCO3属于离子化合物,故D正确。


科目:高中化学 来源: 题型:
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5 的H2S溶液中,c(H+)>c(HS-)=1×10-5mol/L
B. 将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]()
C. pH之和为14的H2C2O4与NaOH 溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
D. 0.1 mol / L 的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是


A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2 周围最近且等距离的CO2有8个
D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①④⑥⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH<7的降雨是酸雨
B. 氯气泄漏后应顺风向低处跑
C. SO2与水反应生成硫酸
D. 我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·黑龙江省牡丹江市第一高级中学月考)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验分析:
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据杂化轨道理论判断下列分子的空间构型是V形的是_____(填序号)。
a . BeCl2 b . H2O c . HCHO d . CS2
(2)己知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃ 就开始升华,则AlCl3的晶体类型为_______;为什么工业上一般不采用电解熔融氯化铝的方法制备金属铝________。 (3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2。T的基态原子外围电子(价电子)排布式为__________, Q2+的未成对电子数是______。
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的_______(填序号)。

(5)[Cu(NH3)4]2+配离子中存在的化学键类型有_______(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3 被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________。
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a 和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是_____cm 。( NA表示阿伏伽德罗常数,用含p、a、b、N的代数式表达)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com