
X、Y、Z、V、W是元素周期表前四周期中的五种常见元素,其相关信息如下表;
|
元素 |
相关信息 |
|
X |
X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
|
Y |
Y是地壳中含量最多的元素 |
|
Z |
Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
|
V |
V的单质是淡黄色固体,是黑火药的一种主要成分 |
|
W |
W的单质是人们最早发现和使用的金属之一 |
(1)X位于第___周期____族。
(2)写出Z2Y2与水反应的离子方程式 。
(3)X和V形成的化合物是一种无色液体,其合成方法之一是一定条件下用含氢质量分数最大的有机物和V的单质为原料,同时生成一种臭鸡蛋气味的气体。请写出化学反应方程式 。
(4)已知:W2Y3(s)+3XY(g)=2W(s)+3XY2(g) △H=–26.7kJ·mol-1
3W2Y3(s)+XY(g)=2W3Y4(s)+XY2(g) △H=–50.75 kJ·mol-1
W3Y4(s)+XY(g)=3WY(s)十XY2(g) △H=–36.5 kJ·mol-1
则相同条件下,反应WY(s)+XY(g)=W(s)+XY2(g)的△H= 。
(1)二、ⅣA (2)2Na2O2+2H2O=4Na++4OH-+O2↑
(3)CH4+4S CS2+2H2S
(4)+7.3kJ/mol
CS2+2H2S
(4)+7.3kJ/mol
【解析】
试题分析:X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应,则X是碳元素;Y是地壳中含量最多的元素,因此Y是氧元素;Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源,该化合物是过氧化钠,则Z是Na元素;V的单质是淡黄色固体,是黑火药的一种主要成分,所以V是S元素;W的单质是人们最早发现和使用的金属之一,因此是Fe元素。
(1)碳元素的原子序数是6,位于第二正确第ⅣA族。
(2)过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
(3)含氢质量分数最大的有机物是甲烷,V的单质为S,具有臭鸡蛋气味的气体是H2S,因此该反应的化学方程式为CH4+4S CS2+2H2S。
CS2+2H2S。
(4)已知①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=–26.7kJ·mol-1、②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=–50.75 kJ·mol-1、③Fe3O4(s)+CO(g)=3FeO(s)十CO2(g) △H=–36.5 kJ·mol-1,因此根据盖斯定律可知(①×3-②-③×2)÷6即得到反应FeO(s)+CO(g)=Fe(s)+CO2(g),所以该反应的△H=(–26.7kJ·mol-1×3+50.75 kJ·mol-1+36.5 kJ·mol-1×2)÷6=+7.3kJ/mol。
考点:考查元素推断、元素周期表的结构、反应热的计算等


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:单选题
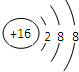
【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是 ;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是 。
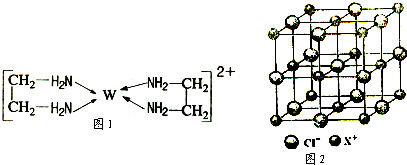
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是 ;每个X+周围与其紧邻的Cl-围成的几何图形为 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期三调考试化学试卷(解析版) 题型:填空题
(11分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2—CH2—NH2)形成配离子:
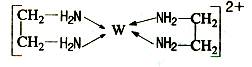
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性”或
“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com