
将0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为_____________________。又已知:H2O(g)![]() H2O(l) ΔH2=-44.0 kJ·mol-1,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是? ? kJ。?
H2O(l) ΔH2=-44.0 kJ·mol-1,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是? ? kJ。?
B2H6(g)+3O2(g) ![]() B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1? 1 016.5
B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1? 1 016.5
0.3 mol乙硼烷完全燃烧生成液态水放出649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为:1 mol×649.5 kJ/0.3 mol=2 165 kJ。因此乙硼烷燃烧的热化学反应方程式为:B2H6(g)+3O2(g) ![]() B2O3(s)+3H2O(l) ΔH=2 165 kJ·mol-1。由于1 mol水汽化需吸热44 kJ,则3 mol液态水全部汽化应吸热:3 mol×44 kJ·mol-1=132 kJ,所以1 mol乙硼烷完全燃烧产生气态水时放热:2 165 kJ-132 kJ=2 033 kJ,则11.2 L(标准状况)乙硼烷完全燃烧产生气态水放出的热量是:0.5 mol×2 033 kJ·mol-1=1 016.5 kJ。?
B2O3(s)+3H2O(l) ΔH=2 165 kJ·mol-1。由于1 mol水汽化需吸热44 kJ,则3 mol液态水全部汽化应吸热:3 mol×44 kJ·mol-1=132 kJ,所以1 mol乙硼烷完全燃烧产生气态水时放热:2 165 kJ-132 kJ=2 033 kJ,则11.2 L(标准状况)乙硼烷完全燃烧产生气态水放出的热量是:0.5 mol×2 033 kJ·mol-1=1 016.5 kJ。?


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学反应速率和化学平衡练习卷(解析版) 题型:填空题
工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl4(g)、0.2 mol N2(g)、0.6 mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si3N4(s)的质量是5.60 g。
(1)H2的平均反应速率是 mol·L-1·min-1。
(2)平衡时容器内N2的浓度是 mol·L-1。
(3)SiCl4(g)的转化率是 。
(4)若按n(SiCl4)∶n(N2)∶n(H2)=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。
选项投料方式
An(SiCl4)∶n(N2)∶n(H2)=1∶1∶2
Bn(SiCl4)∶n(N2)∶n(H2)= 1∶2∶2
Cn(SiCl4)∶n(N2)∶n(H2)= 3∶2∶2
Dn(SiCl4)∶n(N2)∶n(H2)= 2∶1∶3
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si3N4的物质的量减小
D.重新平衡时c(H2)/c(HCl)增大
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京门头沟区高三年级抽样测试理科综合能力测试化学部分 题型:填空题
(14分)
科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为: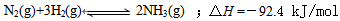
该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
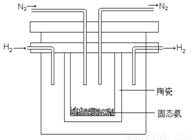
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
⑶根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:

进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知

⑷ NH4Cl溶液呈酸性,这是由于NH 水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是
。
水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是
。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期第一次月考(理综)化学部分 题型:填空题
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1) 某温度下,将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2(10分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。

⑴达到平衡所需要的时间:t(A) t(B),
⑵达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑶达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量 ,B容器中SO2的百分含量 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 ℃时,将0.40 mol的二氧化氮气体充入2 L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____ mol·L-1·s-1。
(2)n3__________n4(填“>”、“<”或“=”),该反应的平衡常数为________(保留小数点后一位)。ks5u
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是________ mol·L-1,假设在80 s时达到平衡,请在图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。

(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)![]() N2O4(g)的平衡常数将________(填“增大”、“减小”或“不变”)。
N2O4(g)的平衡常数将________(填“增大”、“减小”或“不变”)。
(5)达到平衡后,如向该密闭容器中再充入0.32 mol氦气,并把容器体积扩大为4 L,则平衡将______(填“向左移动”、“向右移动”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com