
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为:_________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称________________;
D中含官能团名称________________。
(3)写出反应的化学方程式及反应类型:
①__________________;反应类型:________。
②__________________;反应类型:________。
③__________________;反应类型:________。
【答案】![]() (或
(或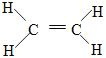 ) 羟基 羧基 CH2=CH2+H2O
) 羟基 羧基 CH2=CH2+H2O![]() CH3CH2OH 加成反应 2CH3CH2OH+O2
CH3CH2OH 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 nCH2=CH2
2CH3CHO+2H2O 氧化反应 nCH2=CH2![]()
![]() 加聚反应
加聚反应
【解析】
乙烯与水发生加成反应生成B,则B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成CH3CHO,C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH。乙烯发生加聚反应生成聚乙烯(![]() ),据此分析解答。
),据此分析解答。
(1)乙烯的结构式为: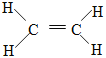 ,故答案为:
,故答案为: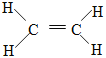 ;
;
(2)由上述分析可知,B为CH3CH2OH,官能团为羟基;D为CH3COOH,官能团为羧基,故答案为:羟基;羧基;
(3)反应①是乙烯与水发生加成反应生成乙醇,反应的化学方程式为:CH2=CH2+H2O ![]() CH3CH2OH;反应②是乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,反应的化学方程式为:2CH3CH2OH+O2
CH3CH2OH;反应②是乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,反应的化学方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;反应③是乙烯发生加聚反应生成聚乙烯,反应的化学方程式为:nCH2=CH2
2CH3CHO+2H2O;反应③是乙烯发生加聚反应生成聚乙烯,反应的化学方程式为:nCH2=CH2 ![]()
![]() ,故答案为:CH2=CH2+H2O
,故答案为:CH2=CH2+H2O ![]() CH3CH2OH;加成反应;2CH3CH2OH+O2
CH3CH2OH;加成反应;2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;氧化反应;nCH2=CH2
2CH3CHO+2H2O;氧化反应;nCH2=CH2 ![]()
![]() ;加聚反应。
;加聚反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】80 ℃时,将0.4 mol的四氧化二氮气体充入2 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s c(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100 s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为______________________________________________。
(2)表中b=______,c______d(填“<”“=”或“>”)。
(3)20 s时,N2O4的浓度为______mol·L-1,0~20 s内N2O4的平均反应速率为________。
(4)该反应的平衡常数表达式K=_____,在80 ℃时该反应的平衡常数K值为________。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
E.所耗时间越少 F.容器内气体压强越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪些材料是新型无机材料 ( )
① 氧化铝陶瓷 ② 氮化硅陶瓷 ③ 碳化硅陶瓷 ④ 氮化铝陶瓷
⑤ 氮化钛陶瓷 ⑥ 硅化硼陶瓷 ⑦ 二硅化铜陶瓷
A.①②③B.①③④⑤C.①⑤⑥D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是
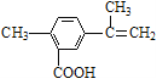
A. 在一定条件下,能发生取代、酯化和加聚反应
B. 该物质能使酸性KMnO4溶液褪色
C. lmol该物质最多可与5molH2发生加成反应
D. lmol该物质完全燃烧最多可消耗13mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意( )
A.通入充足的氧气B.避免与氧气接触
C.可在氮气气氛中合成D.通入少量氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
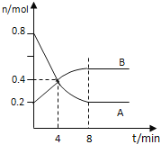
(1)该反应的化学方程式为________________;
(2)前4分钟,A的速率为__________________,平衡时A的转化率是_________
(3)第4min时,正、逆反应速率的大小关系为:v (正)__ v (逆);(填“>”、“<”或“=”)
(4)以下措施能加快反应速率的是___________。
A 恒温恒容充入He使压强增大 B 缩小体积,使压强增大
C 恒温恒压充入He D 平衡后加入催化剂
(5)下列叙述能说明该反应已达到化学平衡状态的是________。
A 容器内压强不再发生变化
B A的体积分数不再发生变化
C 容器内气体原子总数不再发生变化
D 相同时间内消耗2n molA的同时生成n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-)
B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() ________(填“能”或“不能”)大量共存。
________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=![]() =2×10-4,当溶液中c(
=2×10-4,当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com