
【题目】用石墨做电极电解CuCl2溶液,下列说法正确的是( )
A. 在阳极上析出金属铜 B. 在阴极上析出金属铜
C. 在阴极上产生有刺激性气味的气体 D. 阳极上发生还原反应
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______,如果司机酒驾检查时该物质显示的颜色变化是_____________________。
(2)关于R单质晶体的说法正确的是______________。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:

已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________。
(4)W的原子半径为r,其晶体的空间利用率______________(用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______,中心原子的杂化方式为_____
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
![]()
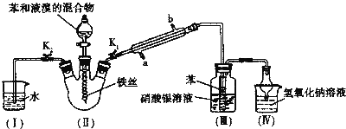
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____。能说明苯与液溴发生了取代反应的现象是_____。Ⅳ中球形干燥管的作用是_____。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再_____,这样操作的目的是_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
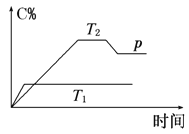
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
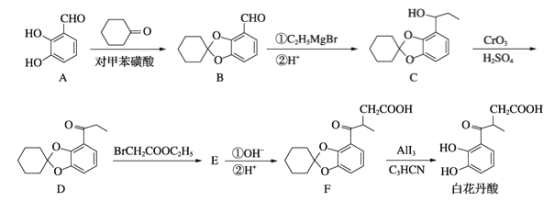
(1)A中的含氧官能团名称为_______和________。
(2)C-D的反应类型为__________。
(3)写出物质D到E的反应方程式_____________。
(4)白花丹酸分子中混有 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式_______________________。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式_______________________。
①分子中有四种不同化学环境的氢;
②与FeCl3溶液能发生显色反应,且1mol该物质最多能与3molNaOH反应。
(5)E的结构简式为__________。
(6)已知:R-Br![]() RMgBr。根据已有知识并结合相关信息写出以
RMgBr。根据已有知识并结合相关信息写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图(合成路线流程图示例见本题题干)____________________
的合成路线流程图(合成路线流程图示例见本题题干)____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 用肥皂(主要成份C17H35COONa)水检验含有较多钙离子的硬水:2C17H35COO-+Ca2+===(C17H35COO)2Ca↓
B. 将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
C. 常温下,在![]() =0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
D. 在NaC1O溶液中:SO32-、OH-、C1-、K+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单二苯乙炔类化合物是![]() 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
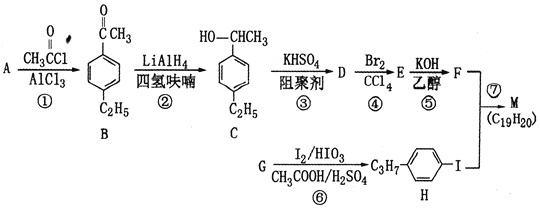
回答下列问题:
(1)G的结构简式为________________。
(2)C中含有的官能团名称是________________________。
(3)反应②的反应类型是________________,反应⑥的反应类型是________________。
(4)反应⑤的化学方程式为____________________。
(5)能同时满足下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有两个取代基 ②能发生银镜反应
写出其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式_______。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线。_________________________
的合成路线。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
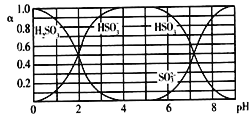
A. 溶液的pH=5时,硫元素的主要存在形式为HSO3-
B. 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 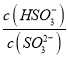 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com