
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)乙炔在Pd表面选择加氢的反应机理如图,其中吸附在Pd表面上的物种用*标注。

上述反应为_____(填“放热”或“吸热”)反应,历程中最小能垒(活化能)为_____kJ/mol,该步骤的化学方程式为_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术。原理为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

A.用催化剂A前50s平均反应速率v(N2)=2.5×10﹣2 mol/(Ls)
B.体系各物质状态不变时,反应在任何温度下均可自发进行
C.分离出体系中的H2O(g)有利于氮氧化物的脱除
D.用催化剂C达到平衡时,N2产率最小
(3)废气的变废为宝越来越成为人们共同关注的焦点,某化学课外小组查阅资料得知:
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2) △H2<0
请回答下列问题:
①一定温度下,2NO(g)+O2(g)![]() 2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,原因是_____。
③已知:N2O4(g)![]() 2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。

【答案】放热 +66 C2H2*+H*=C2H3* BC ![]() 升高温度,化学平衡向吸热的逆反应方向移动,导致容器中c(N2O2)减小,则反应II速率变慢,反应II速率决定整个反应速率,所以反应速率减慢 B、D A、C
升高温度,化学平衡向吸热的逆反应方向移动,导致容器中c(N2O2)减小,则反应II速率变慢,反应II速率决定整个反应速率,所以反应速率减慢 B、D A、C
【解析】
(1)反应物总能量大于生成物总能量,则该反应为放热反应,否则为吸热反应;反应物和过渡态的能量差越小活化能越小;
(2)A. 先分析0~50 s在催化剂A作用下N2物质的量变化值,然后根据速率公式计算;
B. 根据△G=△H-T△S<0的反应可自发进行;
C. 根据浓度对平衡移动的影响分析;
D. 催化剂只能改变反应所以,不影响平衡移动;
(3)①根据平衡常数的含义,分别计算K1、K2,将方程式叠加,可得待求反应的化学平衡常数K与K1、K2关系式,再转化为k1、k2表示的值;
②升高温度平衡向吸热方向移动,导致容器中c(N2O2)减小;
③如果2v(N2O4)=v(NO2)时,该反应达到平衡状态,如果2v(N2O4)>v(NO2),则平衡正向移动。
(1)根据图知,反应物乙炔总能量大于生成物乙烯的能量,则该反应为放热反应,反应物和过渡态的能量差越小活化能越小,C2H2*+H*=C2H3* △H=+66 kJ/mol的活化能最小,为+66kJ/mol,该步骤的化学方程式为C2H2*+H*=C2H3*;
(2)A. 在0~50 s在催化剂A作用下n(N2)=2.5×10-3 mol,平均反应速率v(N2)=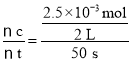 =2.5×10-5 mol/(L·s),A错误;
=2.5×10-5 mol/(L·s),A错误;
B.△G=△H-T△S<0的反应可自发进行,△H<0,由化学计量数可知△S>0,该反应在任何温度下均可自发进行,B正确;
C.减小生成物浓度,平衡正向移动,有利于氮氧化物的反应,可更利于氮氧化物的脱除,C正确;
D.催化剂不能使化学平衡发生移动,所以最终氮气产率相等,D错误;
故合理选项是BC;
(3)①Ⅰ. 2NO(g)![]() N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2),当反应达到平衡时,v1正= v1逆,=k1正c2(NO)= k1逆c(N2O2),该反应K1=
N2O2(g) (快) v1正=k1正c2(NO),v1逆═k1逆c(N2O2),当反应达到平衡时,v1正= v1逆,=k1正c2(NO)= k1逆c(N2O2),该反应K1=![]() ;
;
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2),反应达到平衡时,v2正= v2逆,k2正c(N2O2)c(O2)= k2逆c2(NO2),该反应K2=
2NO2(g)(慢) v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2),反应达到平衡时,v2正= v2逆,k2正c(N2O2)c(O2)= k2逆c2(NO2),该反应K2=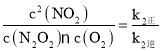 ,两个方程式相加,则化学平衡常数相乘;
,两个方程式相加,则化学平衡常数相乘;
方程式I+II整理可得:2NO(g)+O2(g)![]() 2NO2(g)平衡常数K= K1·K2=
2NO2(g)平衡常数K= K1·K2=![]() ;
;
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,反应开始时,升高温度,物质内能增加,有效碰撞次数增加,反应速率加快,当反应达到平衡后,升高温度,化学平衡向吸热的逆反应方向移动,导致容器中c(N2O2)减小,则反应II速率变慢,反应II速率决定整个反应速率,所以反应速率减慢;
③如果2v(N2O4)=v(NO2)时,该反应达到平衡状态,D点纵坐标是B点的2倍,则D、B点存在2v(N2O4)=v(NO2),这两点为平衡状态;如果2v(N2O4)>v(NO2),则平衡正向移动,C点纵坐标大于A点,则A、C这两个点表示反应正向进行。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
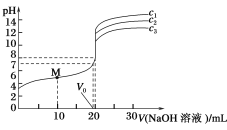
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=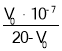 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷具有类似樟脑气味的无色晶体,其衍生物在医药方面有着重要的用途。以化合物X为起始原料没生一系列反应制得金刚烷(Z)的过程如图所示,下列说法不正确的是

A. X的分子式为C10H12
B. X生成Y的反应为还原反应
C. Y和Z互为同分异构体
D. Z和环已烷属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及 CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
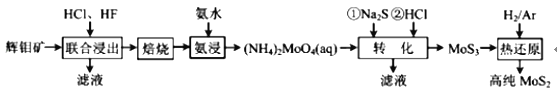
回答下列问题:
(1)(NH4)2MoO4中Mo的化合价为_____。
(2)“联合浸出”中HF除去的杂质化学式为_____,“焙烧”时MoS2转化为MoO3的化学方程式为_____。
(3)“转化”中加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出(NH4)2MoS4与盐酸生成MoS3的离子方程式_____。
(4)由图分析产生MoS3沉淀的流程中应选择的最优温度和时间是_____,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____。
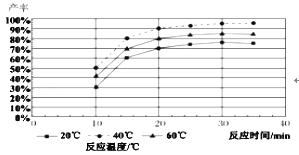
(5)高纯MoS2中存在极微量非整比晶体杂质MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为_____。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的 Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当SO42-完全沉淀时,溶液中c(MoO42-)<_____mol/L(保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol/L的溶液,溶解过程如图所示,下列说法正确的是
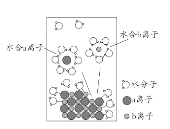
A.a离子为Na+
B.溶液中存在NaCl![]() Na++Cl-
Na++Cl-
C.溶液中含有NA个水合Na+和NA个水合Cl-
D.在水分子的作用下,NaCl溶解的同时发生了电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H属于大位阻醚系列中的一种,在有机化工领域具有十分重要的价值。2018年我国首次使用α﹣溴代羰基化合物合成大位阻醚H,其合成路线如图:
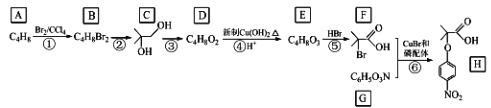
回答下列问题:
(1)A的名称是_____。
(2)H中的官能团名称是_____,①~⑥中属于取代反应的是_____(填序号)。
(3)反应②所需的试剂和条件是_____,③的化学方程式是_____。
(4)化合物X是E的同分异构体,X不能与 NaHCO3溶液反应,能与NaOH溶液反应,又能与金属钠反应。符合上述条件的X的同分异构体有_____种(不考虑立体异构)。其中核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_____。
(5)请写出以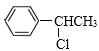 和
和![]() 为原料合成另一种大位阻醚
为原料合成另一种大位阻醚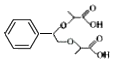 的合成路线:_____。
的合成路线:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A.A的结构简式为![]()
B.反应④的反应试剂和反应条件是浓H2SO4加热
C.①②③的反应类型分别为取代、消去、加成
D.环戊二烯可发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:

已知:
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com