
【题目】下列说法中不正确的是
A.标准状况下,22.4L氦气含有所含的原子数约为6.02×1023
B.标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C.22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同
D.标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应为![]() ,则下列说法中错误的是( )
,则下列说法中错误的是( )
A.a的值为2B.反应中SnO2被还原
C.反应后有两种氧化产物D.1mol SnO2参加反应电子转移8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
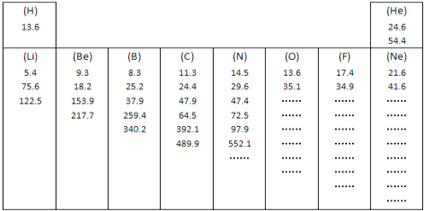
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____(填序号),易溶于水的有_____(填序号),理由是:____________。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________,说明N2中________键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。某研究小组欲用以下三种方案制备ClO2,回答下列问题:
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
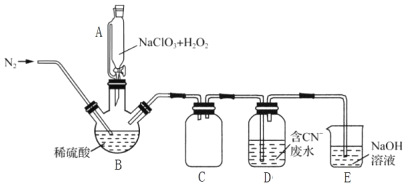
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
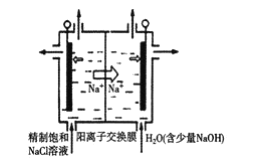
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:
①H2O②NH3③NH3H2O④乙醇⑤乙烯⑥CO2⑦CuSO45H2O⑧甲烷⑨H2O2
含非极性键的极性分子有( )
A.①②⑥B.③④⑦C.④⑨D.③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.已知甲池的总反应式为: 2CH3OH+3O2+4KOH![]()
![]() 2K2CO3+6H2O
2K2CO3+6H2O
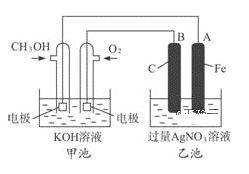
请填空:
(1)充电时:①燃料电池的正极与电源______极相连.
②阳极的电极反应式为__________________________________.
(2)放电时:负极的电极反应式为______________________________.
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2______L(标准状况下).
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:_________________________.
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应式为____________________,负极反应式为___________________;若在常温下转移2mol电子,可产生水质量为_________g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L(标准状况)气体。此时氢氧燃料电池中消耗H2的质量是_______,混合溶液中NaOH的物质的量浓度是__________mol·L-1。
(3)已知可逆反应:AsO43-+2I-+2H+![]() AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
AsO33-+I2+H2O。如图所示,C1棒和C2棒都是石墨电极。
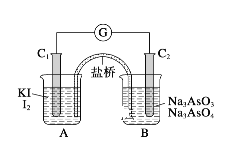
(Ⅰ)若向B中逐滴加入浓盐酸,上述反应向右进行,发现检流计指针向左偏转。
(Ⅱ)若改用向B中滴加40%的NaOH溶液,发现检流计指针与(Ⅰ)中偏转方向相反。
试回答问题:
操作(Ⅰ)中,C1棒上的反应式为_____________________________。
操作(Ⅱ)中,C2棒上的反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可通过下列流程回收废旧锂离子电池正极材料(LiCoO2,含少量Al、Fe)中的钴和锂。

回答下列问题:
(1)“酸溶、还原”过程中S2O32-转化为SO42-,LiCoO2参与反应的离子方程式为____________________________________。
(2)“废渣”的主要成分为___________________。
(3)“沉钴”过程中,当溶液的pH=10时,c(Co2+)=______mol· L-1(已知常温下KSP[Co(OH)2]=1.58×10-15)。
(4)在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。

290℃时,完全脱水变为Co2O3,反应的化学方程式为_______________;500℃时的主要产物为_____________(填化学式);将1000℃时的分解产物1mol与2.2mol Na2O(稍过量)在充氩封闭管中共热,会生成鲜红色的晶体,该晶体的阴离子为正三角形结构,晶体的化学式为__________________。
(5)“滤液X”中最主要的溶质是_______________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com