
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 常温下,NaHCO3溶液显碱性:HCO3-+H2O?CO32-+H3O+ | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-═H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:Fe2++H2O2+2H+═Fe3++2H2O |
分析 A.吸氧腐蚀时氧气得到电子;
B.NaHCO3溶液显碱性,与水解有关;
C.氢氧化镁在离子反应中保留化学式;
D.电子、电荷不守恒.
解答 解:A.钢铁腐蚀发生吸氧腐蚀时,正极反应为2H2O+O2+4e-═4OH-,故A正确;
B.常温下,NaHCO3溶液显碱性,发生水解的离子反应为HCO3-+H2O?H2CO3+OH-,故B错误;
C.氢氧化镁与稀硫酸反应的离子反应为2H++Mg(OH)2═Mg2++2H2O,故C错误;
D.硫酸亚铁酸性溶液中加入过氧化氢的离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、电极反应、水解反应的离子反应考查,综合性较强,题目难度不大,注意离子反应中保留化学式的物质及电子、电荷守恒.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 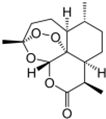 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物总质量之比 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作净水剂的明矾和作消毒剂的漂白粉都是强电解质 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ba2+、OH-、SO42- | B. | Ca2+、H+、Cl-、CO32- | ||
| C. | H+、Ba2+、Ag+、Cl- | D. | K+、OH-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
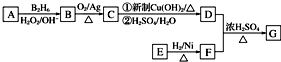
 .
.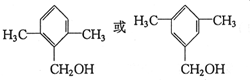 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com