
”¾ĢāÄæ”æI.ijĶ¬Ń§Éč¼ĘČēĶ¼ĖłŹ¾×°ÖĆĢ½¾æĀČĘųÄÜ·ńÓėĖ®·¢Éś·“Ó¦”£ĘųĢåaµÄÖ÷ŅŖ³É·ÖŹĒŗ¬ÓŠÉŁĮæĖ®ÕōĘųµÄĀČĘų”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ


£Ø1£©ĘųĢåaÓÉÓŅĶ¼¼×»ņŅŅÖʱø £¬ČōŃ”ÓĆĶ¼ÖŠµÄ¼××°ÖĆ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_____£¬ČōŃ”ÓĆ×°ÖĆŅŅ£¬ĘäÖŠµÄµ¼¹Ü a µÄ×÷ÓĆŹĒ_____”£
£Ø2£©Ö¤Ć÷ĀČĘųŗĶĖ®·¢Éś·“Ó¦µÄŹµŃéĻÖĻóĪŖ_____________”£
£Ø3£©øĆŹµŃéÉč¼Ę“ęŌŚČ±ĻŻ£¬ĪŖĮĖæĖ·žøĆȱĻŻ£¬ŠčŅŖ²¹³ä×°ÖĆD£¬ĘäÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________________”£
II.ČēĶ¼ĪŖÅØĮņĖįÓėĶ·“Ó¦¼°Ęä²śĪļ¼ģŃéµÄŹµŃé×°ÖĆ

»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Öø³öŹŌ¹ÜcÖŠ²śÉśµÄŹµŃéĻÖĻó£ŗ______________________”£
£Ø2£© ÓĆæɳé¶ÆµÄĶĖæ“śĢęĶʬµÄÓŵć___________”£
£Ø3£©Š“³öÅØĮņĖįÓėĶ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_____________________________”£
”¾“š°ø”æMnO2+ 4H++2Cl-![]() Cl2”ü+Mn2++2H2O Ę½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ ×°ÖĆBÖŠµÄÓŠÉ«²¼Ģõ²»ĶŹÉ«£¬×°ÖĆCÖŠµÄÓŠÉ«²¼ĢõĶŹÉ« Cl2+2OH-=Cl-+ClO-+H2O ŹÆČļŹŌŅŗ±äŗģÉ« æŲÖĘ·“Ó¦ĖꏱæŖŹ¼ĖꏱĶ£Ö¹ Cu+2H2SO4£ØÅØ£©
Cl2”ü+Mn2++2H2O Ę½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ ×°ÖĆBÖŠµÄÓŠÉ«²¼Ģõ²»ĶŹÉ«£¬×°ÖĆCÖŠµÄÓŠÉ«²¼ĢõĶŹÉ« Cl2+2OH-=Cl-+ClO-+H2O ŹÆČļŹŌŅŗ±äŗģÉ« æŲÖĘ·“Ó¦ĖꏱæŖŹ¼ĖꏱĶ£Ö¹ Cu+2H2SO4£ØÅØ£©![]() CuSO4+SO2”ü+2H2O
CuSO4+SO2ӟ+2H2O
”¾½āĪö”æ
I.(1)ČōŃ”ÓĆĶ¼ÖŠµÄ¼××°ÖĆÖʱøĀČĘų£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒMnO2+4H++2Cl- ![]() Mn2++Cl2”ü+2H2O£¬ČōŃ”ÓĆ×°ÖĆŅŅ£¬Ó¦øĆŃ”ŌńøßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ó¦£¬ĘäÖŠµÄµ¼¹ÜaæÉŅŌĘ½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ£¬¹Ź“š°øĪŖ£ŗMnO2+4H++2Cl-
Mn2++Cl2”ü+2H2O£¬ČōŃ”ÓĆ×°ÖĆŅŅ£¬Ó¦øĆŃ”ŌńøßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ó¦£¬ĘäÖŠµÄµ¼¹ÜaæÉŅŌĘ½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ£¬¹Ź“š°øĪŖ£ŗMnO2+4H++2Cl- ![]() Mn2++Cl2”ü+2H2O£»Ę½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ£»
Mn2++Cl2”ü+2H2O£»Ę½ŗāĘųŃ¹£¬Ź¹·ÖŅŗĀ©¶·ÖŠµÄŅŗĢåÄÜĖ³ĄūµĪĻĀ£»
(2)øÉŌļĀČĘų²»¾ßÓŠĘư׊Ō£¬ĀČĘųŗĶĖ®·“Ӧɜ³ÉŃĪĖįŗĶ“ĪĀČĖį£¬·½³ĢŹ½ĪŖ£ŗCl2+H2O=HCl+HClO£¬“ĪĀČĖį¾ßÓŠĘư׊Ō£¬¹Ź“š°øĪŖ£ŗ×°ÖĆBÖŠµÄÓŠÉ«²¼Ģõ²»ĶŹÉ«£¬×°ÖĆCÖŠµÄÓŠÉ«²¼ĢõĶŹÉ«£»
(3)ĀČĘųÓŠ¶¾£¬Ó¦½ųŠŠĪ²Ęų“¦Ąķ£¬²»ÄÜĖęŅāÅŷŵ½æÕĘųÖŠ£¬æÉÓĆ¼īČÜŅŗĄ“ĪüŹÕ£ŗCl2+2NaOH=NaCl+NaClO+H2O£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗCl2+2OH-=Cl-+ClO-+H2O£¬¹Ź“š°øĪŖ£ŗƻӊĪ²ĘųĪüŹÕ×°ÖĆ£»Cl2+2OH-=Cl-+ClO-+H2O£»
II.(1)¶žŃõ»ÆĮņ¾ßÓŠĘư׊Ō£¬ĖłŅŌŹŌ¹ÜbÖŠĘ·ŗģČÜŅŗĶŹÉ«£»¶žŃõ»ÆĮņĪŖĖįŠŌŃõ»ÆĪļ£¬Äܹ»ÓėĖ®·“Ӧɜ³ÉŃĒĮņĖį£¬ĖłŅŌŹŌ¹ÜcÖŠµÄŹÆČļČÜŅŗĻŌŗģÉ«£¬¹Ź“š°øĪŖ£ŗŹÆČļŹŌŅŗĻŌŗģÉ«£»
(2)Ķعż³é¶ÆĶĖ棬·½±ćĖęŹ±ÖŠÖ¹·“Ó¦£¬±ÜĆāĄĖ·ŃŌĮĻ”¢¼õÉŁĪŪČ¾ĘųĢåµÄ²śÉś£¬¹Ź“š°øĪŖ£ŗæŲÖĘ·“Ó¦ĖꏱæŖŹ¼ĖꏱĶ£Ö¹£»
(3)ĶÓėÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ӧɜ³É¶žŃõ»ÆĮņ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu+2H2SO4(ÅØ) ![]() CuSO4+SO2”ü+2H2O£¬¹Ź“š°øĪŖ£ŗCu+2H2SO4(ÅØ)
CuSO4+SO2”ü+2H2O£¬¹Ź“š°øĪŖ£ŗCu+2H2SO4(ÅØ) ![]() CuSO4+SO2”ü+2H2O”£
CuSO4+SO2ӟ+2H2Oӣ


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµēø”єĿ¾Ū·Ø“¦ĄķĖįŠŌĪŪĖ®µÄ¹¤×÷ŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
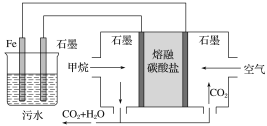
A. Ģśµē¼«µÄµē¼«·“Ó¦Ź½ĪŖFe£2e£===Fe2£«
B. Čō×ó³ŲŹÆÄ«µē¼«²śÉś44.8 L(±ź×¼×“æö)ĘųĢ壬ŌņĻūŗÄ1.0 mol¼×Ķé
C. ĶØČė¼×ĶéµÄŹÆÄ«µē¼«µÄµē¼«·“Ó¦Ź½ĪŖCH4£«4CO32-£8e£===5CO2£«2H2O
D. ĪŖĮĖŌöĒæĪŪĖ®µÄµ¼µēÄÜĮ¦£¬æÉĻņĪŪĖ®ÖŠ¼ÓČėŹŹĮ湤ŅµÓĆŹ³ŃĪ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖ³żČ„“ÖŃĪÖŠµÄCa2£«”¢Mg2£«”¢SO![]() ŅŌ¼°ÄąÉ³µČŌÓÖŹ£¬Ä³Ķ¬Ń§Éč¼ĘĮĖŅ»ÖÖÖʱø¾«ŃĪµÄŹµŃé·½°ø£¬²½ÖčČēĻĀ£ŗ(ÓĆÓŚ³ĮµķµÄŹŌ¼ĮÉŌ¹żĮæ)
ŅŌ¼°ÄąÉ³µČŌÓÖŹ£¬Ä³Ķ¬Ń§Éč¼ĘĮĖŅ»ÖÖÖʱø¾«ŃĪµÄŹµŃé·½°ø£¬²½ÖčČēĻĀ£ŗ(ÓĆÓŚ³ĮµķµÄŹŌ¼ĮÉŌ¹żĮæ)
³ĘČ”“ÖŃĪ![]()
![]()
![]()
![]()
![]() ĀĖŅŗ
ĀĖŅŗ![]()
![]() ¾«ŃĪ
¾«ŃĪ
£Ø1£©µŚ¢Ł²½ÖŠ£¬²Ł×÷AŹĒ________£¬µŚ¢Ż²½ÖŠ£¬²Ł×÷BŹĒ________”£
£Ø2£©µŚ¢Ü²½ÖŠ£¬Š“³öĻąÓ¦µÄ»Æѧ·½³ĢŹ½(¼ŁÉč“ÖŃĪČÜŅŗÖŠCa2£«µÄÖ÷ŅŖ“ęŌŚŠĪŹ½ĪŖCaCl2)_______”£
£Ø3£©ČōĻČÓĆŃĪĖįµ÷pHŌŁ¹żĀĖ£¬½«¶ŌŹµŃé½į¹ū²śÉśÓ°Ļģ£¬ĘäŌŅņŹĒ__________________”£
£Ø4£©ÅŠ¶ĻBaCl2ŅŃ¹żĮæµÄ·½·ØŹĒ___________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬Ö»ŗ¬ÓŠĄė×Ó¼üµÄ»ÆŗĻĪļŹĒ£Ø £©
A. H2OB. CaCl2C. KOHD. Cl2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦xA(g)+ yB(g)![]() zC(g)£¬Ķ¼I±ķŹ¾200”ꏱȯĘ÷ÖŠA”¢B”¢CĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ£¬Ķ¼¢ņ±ķŹ¾²»Ķ¬ĪĀ¶ČĻĀĘ½ŗāŹ±CµÄĢå»ż·ÖŹżĖęĘšŹ¼n(A)£ŗn(B)µÄ±ä»Æ¹ŲĻµ£»ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒ
zC(g)£¬Ķ¼I±ķŹ¾200”ꏱȯĘ÷ÖŠA”¢B”¢CĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»Æ£¬Ķ¼¢ņ±ķŹ¾²»Ķ¬ĪĀ¶ČĻĀĘ½ŗāŹ±CµÄĢå»ż·ÖŹżĖęĘšŹ¼n(A)£ŗn(B)µÄ±ä»Æ¹ŲĻµ£»ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒ

A. Ķ¼IIĖłÖŖ·“Ó¦xA(g)+yB(g) ![]() zC(g) ”÷H<0£¬ĒŅa=2
zC(g) ”÷H<0£¬ĒŅa=2
B. 200”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ25
C. 200”ꏱ£¬·“Ó¦“ÓæŖŹ¼µ½Ę½ŗāµÄĘ½¾łĖŁĀŹv(B)=0.04mol/(Lmin)
D. µ±Ķā½ēĢõ¼žÓÉ200”ę½µĪĀµ½100”ę£¬Ę½ŗāÕżĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøßĢśĖį¼Ų(K2FeO4)ŹĒŅ»ŠĀŠĶ”¢øߊ§”¢ĪŽ¶¾µÄ¶ą¹¦ÄÜĖ®“¦Ąķ¼Į”£
£Ø׏ĮĻ£©K2FeO4ĪŖ×ĻÉ«¹ĢĢ壬Ī¢ČÜÓŚKOHČÜŅŗ£¬¾ßÓŠĒæŃõ»ÆŠŌ£¬ŌŚĖįŠŌ»ņÖŠŠŌČÜŅŗÖŠæģĖŁ²śÉśO2£¬ŌŚ¼īŠŌČÜŅŗÖŠ½ĻĪČ¶Ø”£
£Ø1£©ÖʱøK2FeO4”£
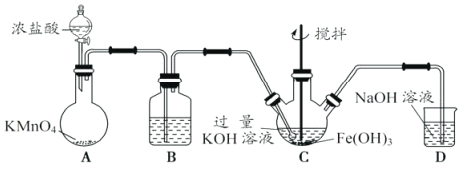
¢ŁAĪŖÖĘČ”ĀČĘų·¢Éś×°ÖĆ£¬ĘäÖŠŹ¢·ÅÅØŃĪĖįµÄŅĒĘ÷Ćū³ĘĪŖ___________”£
¢Ś³żŌÓ×°ÖĆBÖŠµÄŹŌ¼ĮĪŖ___________”£
¢ŪCĪŖÖʱøK2FeO4×°ÖĆ£¬KOHČÜŅŗ¹żĮæµÄŌŅņŹĒ___________”£
¢ÜDĪŖĪ²Ęų“¦Ąķ×°ÖĆ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________”£
£Ø2£©Ģ½¾æ K2FeO4µÄŠŌÖŹ”£Č”CÖŠ×ĻÉ«ČÜŅŗ£¬¼ÓČėĻ”ĮņĖį£¬²śÉśüSĀĢÉ«ĘųĢ壬µĆČÜŅŗa£¬¾¼ģŃéĘųĢåÖŠŗ¬ÓŠCl2”£ĪŖÖ¤Ć÷K2FeO4ÄÜ·ńŃõ»ÆCl£¶ų²śÉśCl2£¬Éč¼ĘŅŌĻĀ·½°ø£ŗ
·½°øI | ȔɣĮæČÜŅŗa£¬µĪ¼ÓKSCNČÜŅŗÖĮ¹żĮ棬ČÜŅŗ³ŹŗģÉ«”£ |
·½°ø¢ņ | ÓĆKOHČÜŅŗ³ä·ÖĻ“µÓCÖŠĖłµĆ¹ĢĢ壬ŌŁÓĆKOHČÜŅŗ½«K2FeO4Čܳö£¬µĆµ½×ĻÉ«ČÜŅŗb”£Č”ÉŁĮæb£¬µĪ¼ÓŃĪĖį£¬ÓŠCl2²śÉś”£ |
¢ŁÓÉ·½°øIÖŠČÜŅŗ±äŗģæÉÖŖaÖŠŗ¬ÓŠ___________”£øĆĄė×ӵIJśÉś___________(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)ÅŠ¶ĻŅ»¶ØŹĒÓÉK2FeO4±»Cl£»¹Ō¶ųŠĪ³ÉµÄ”£
¢Ś·½°ø¢ņÓĆKOHČÜŅŗĻ“µÓµÄÄæµÄŹĒ___________”£·½°ø¢ņµĆ³öŃõ»ÆŠŌ£ŗCl2___________FeO42£(Ģī”°>”±»ņ”°<”±)
£Ø3£©Ź¹ÓĆŹ±¾³£Ķعż²ā¶ØøßĢśĖį¼ŲµÄ“æ¶ČĄ“ÅŠ¶ĻĘäŹĒ·ń±äÖŹ”£K2FeO4ŌŚĮņĖįČÜŅŗÖŠ·“Ó¦ČēĻĀ£ŗ_______ FeO42£+______H+===_______O2”ü+________Fe3++________(ÅäĘ½¼°Ķź³ÉÉĻŹöĄė×Ó·½³ĢŹ½)________”£ĻÖČ”CÖŠĻ“µÓ²¢øÉŌļŗóѳʷµÄÖŹĮæ10g£¬¼ÓČėĻ”ĮņĖį£¬ŹÕ¼Æµ½0.672LĘųĢå(±ź×¼×“æöĻĀ)”£Ōņѳʷ֊øßĢśĖį¼ŲµÄÖŹĮæ·ÖŹżŌ¼ĪŖ___________”£(¼ĘĖć½į¹ū±£Įōµ½0.1%)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪļÖŹŌŚĖ®ÖŠæÉÄÜ“ęŌŚµēĄėĘ½ŗā”¢ŃĪµÄĖ®½āĘ½ŗāŗĶ³ĮµķµÄČܽāĘ½ŗā,ĖüĆĒ¶¼æÉæ“×÷»ÆŃ§Ę½ŗā”£Ēėøł¾ŻĖłŃ§ÖŖŹ¶»Ų“š:
(1)AĪŖ0.1 mol”¤L-1µÄ(NH4)2SO4ČÜŅŗ,ŌŚøĆČÜŅŗÖŠø÷ÖÖĄė×ÓµÄÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ__________.
(2)BĪŖ0.1mol”¤L-1 NaHCO3ČÜŅŗ,Ēė·ÖĪöNaHCO3ČÜŅŗĻŌ¼īŠŌµÄŌŅņ__________.
(3)DĪŖŗ¬ÓŠ×ćĮæAgCl¹ĢĢåµÄ±„ŗĶČÜŅŗ,ĀČ»ÆŅųŌŚĖ®ÖŠ“ęŌŚ³ĮµķČܽāĘ½ŗā:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
ŌŚ25 ”ꏱ,ĀČ»ÆŅųµÄKsp=1.8”Į10-10”£ĻÖ½«×ćĮæĀČ»ÆŅų·Ö±š·ÅČė£ŗ
¢Ł100 mL ÕōĮóĖ®ÖŠ; ¢Ś100 mL 0.2 mol”¤L-1 AgNO3ČÜŅŗÖŠ;
¢Ū100 mL 0.1 mol”¤L-1ĀČ»ÆĀĮČÜŅŗÖŠ; ¢Ü100 mL 0.1 mol”¤L-1ŃĪĖįČÜŅŗÖŠ,
³ä·Ö½Į°čŗó,ĻąĶ¬ĪĀ¶ČĻĀŅųĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ________(ĢīŠ“ŠņŗÅ);¢ŚÖŠĀČĄė×ÓµÄÅضČĪŖ______ mol”¤L-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)ijĪĀ¶ČĻĀ£¬Ļņ2m g 16%µÄCuSO4ČÜŅŗÖŠ¼ÓČėm g CuSO45H2O£¬ČÜŅŗĒ”ŗĆ“ļµ½±„ŗĶ£¬øƱ„ŗĶČÜŅŗÖŠCuSO4µÄÖŹĮæ·ÖŹżĪŖ_____”£
(2)±ź×¼×“æöĻĀ£¬1Ģå»żĖ®æÉČܽāVĢå»żHClĘųĢ壬ĖłµĆČÜŅŗµÄĆܶČĪŖ¦Ńg/cm3£¬ŌņĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹż±ķŹ¾ĪŖ_____£¬ČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č±ķŹ¾ĪŖ_____”£
(3)ČōŅŌ¦Ų1ŗĶ¦Ų2·Ö±š±ķŹ¾ÅضČĪŖa molL©1ŗĶb molL©1ĮņĖįČÜŅŗµÄČÜÖŹµÄÖŹĮæ·ÖŹż£¬ĒŅÖŖ 2a£½b£¬ŌņĻĀĮŠĶʶĻÕżČ·µÄŹĒ(ĮņĖįČÜŅŗµÄĆܶȱȓæĖ®µÄ“ó)_____(ĢīŠņŗÅ)
A. 2¦Ų1£½¦Ų2 B. ¦Ų2£¼2¦Ų1 C. ¦Ų2£¾2¦Ų1 D. ¦Ų1£¼¦Ų2£¼2¦Ų1
(4)ČōŅŌ¦Ų1ŗĶ¦Ų2·Ö±š±ķŹ¾ÅضČĪŖa molL©1ŗĶb molL©1°±Ė®µÄČÜÖŹµÄÖŹĮæ·ÖŹż£¬ĒŅÖŖ2¦Ų1£½¦Ų2£¬ŌņĻĀĮŠĶʶĻÕżČ·µÄŹĒ(°±Ė®µÄĆܶȱȓæĖ®µÄŠ”)_____(ĢīŠņŗÅ)
A. 2a£½b B. 2a£¼b C. 2a£¾b D. a£¼b£¼2a£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĀŠĶĖ®ĻµÄĘĄė×Óµē³Ų¹¤×÷ŌĄķČēĻĀĶ¼ĖłŹ¾”£TiO2¹āµē¼«ÄÜŹ¹µē³ŲŌŚĢ«Ńō¹āÕÕĻĀ³äµē£¬³äµēŹ± Na2S4×Ŗ»ÆĪŖ Na2S”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
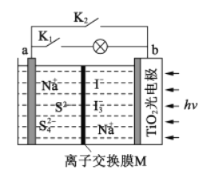
A. ³äµēŹ±£¬Ģ«ŃōÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ£¬»ÆѧÄÜÓÖ×Ŗ»ÆĪŖµēÄÜ
B. ·ÅµēŹ±£¬a¼«ĪŖÕż¼«
C. ³äµēŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ3I--2e-=I3-
D. MæÉŅŌŹ¹ÓĆŅõĄė×Ó½»»»Ä¤
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com