
分析 (1)0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,c(H+)=10-3mol/L,据此计算溶液的pH;
(2)加水稀释,醋酸的电离平衡正向移动,氢离子和醋酸根离子物质的量增大,浓度减小,据此分析;
(3)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离为主.
解答 解:Ⅱ、(1)0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,溶液中氢离子浓度为0.1mol/L×1%=0.001mol/L,则溶液PH=3;
故答案为:3;
(2)CH3COOH?CH3COO-+H+,溶液加蒸馏水稀释,在稀释过程中,电离程度增大,下列各项中增大的是;
A、电离平衡加入水稀释,c(H+)减小,故A错误;
B、电离平衡加入水稀释促进电离,溶液中氢离子物质的量增大,醋酸分子物质的量减小,所以 $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大,故B正确;
C、温度一定,加入水 促进电离,溶液中c(H+)•c(OH-)为常数不变,故C错误;
D、电离平衡加入水稀释促进电离,氢离子浓度减小,依据离子积常数氢氧根离子浓度增大,比值增大,故D正确;
故答案为:BD.
(3)CH3COOH与CH3COONa的混合溶液呈酸性,以CH3COOH的电离程度大于CH3COONa的水解程度所以c(CH3COO-)>c(Na+),溶液显酸性,c(H+)>c(OH-),因此c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了弱电解质的电离和盐类的水解,及离子浓度大小比较,注意平衡常数的应用和推断分析,题目难度中等.


科目:高中化学 来源: 题型:解答题

 )就是其中的一种.
)就是其中的一种. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④⑤ | B. | 只有③ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由题给△H值可知,该反应是一个放热反应 | |
| B. | △S>0表明该反应是一个熵增加的反应 | |
| C. | 该反应在室温下可能自发 | |
| D. | 不能确定该反应能否自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A物质的量 | B. | 降低温度 | ||
| C. | 压缩反应容器体积 | D. | 消耗掉部分B物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
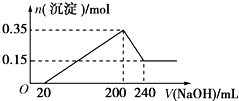 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将石灰石加入新制氯水中,固体逐渐溶解(H+) | |
| B. | 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) | |
| C. | 使红色布条褪色(HCl) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用环形玻璃搅拌棒轻轻搅动混合液 | |
| B. | 实验中应使用相同浓度和体积的氢氧化钠溶液和盐酸溶液 | |
| C. | 实验中两个大小不同的烧杯间要填满碎纸条,目的是减少实验过程中热量的损失 | |
| D. | 用相同体积的浓硫酸代替盐酸溶液进行实验,测得中和热的数值比理论值偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com