
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
【答案】AB ![]() 消去反应 保护酚羟基,防止在反应②中被氧化 NaHCO3溶液
消去反应 保护酚羟基,防止在反应②中被氧化 NaHCO3溶液 ![]() 或
或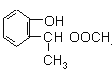
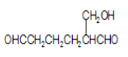 +4Ag(NH3)2OH
+4Ag(NH3)2OH![]()
 +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
【解析】
A的结构简式为![]() ,A发生水解反应得到C与
,A发生水解反应得到C与![]() ,可知C为CH3COOH,由转化关系可知,
,可知C为CH3COOH,由转化关系可知,![]() 与氢气发生加成生成F为
与氢气发生加成生成F为![]() ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为![]() ,H为
,H为![]() .
.![]() 与氢氧化钠水溶液放出生成B为
与氢氧化钠水溶液放出生成B为![]() ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为![]() ,E为
,E为![]() ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到![]() ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
A的结构简式为![]() ,A发生水解反应得到C与
,A发生水解反应得到C与![]() ,可知C为CH3COOH,由转化关系可知,
,可知C为CH3COOH,由转化关系可知,![]() 与氢气发生加成生成F为
与氢气发生加成生成F为![]() ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为![]() ,H为
,H为![]() .
.![]() 与氢氧化钠水溶液放出生成B为
与氢氧化钠水溶液放出生成B为![]() ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为![]() ,E为
,E为![]() ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到![]() ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
(1)A.C为CH3COOH,C的官能团为羧基,故A正确;B.A为![]() ,酯基、酚羟基与氢氧化钠反应,1mol A最多可以和2mol NaOH反应,故B正确;C.C为CH3COOH,可以发生氧化反应、取代反应,不能发生加成反应,故C错误;D.
,酯基、酚羟基与氢氧化钠反应,1mol A最多可以和2mol NaOH反应,故B正确;C.C为CH3COOH,可以发生氧化反应、取代反应,不能发生加成反应,故C错误;D.![]() 中羟基的邻位碳上没有氢原子,所以不能发生消去反应,故D错误;故答案为AB;
中羟基的邻位碳上没有氢原子,所以不能发生消去反应,故D错误;故答案为AB;
(2)由上述分析可知,F为![]() ,由上述发生可知F到G的反应类型为 消去反应;
,由上述发生可知F到G的反应类型为 消去反应;
(3)反应①的作用是:是保护酚羟基,防止在反应②中被氧化,合适的试剂a为NaHCO3溶液;
(4)同时满足下列条件的A(![]() )的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,Ⅲ.1H-NMR分析,分子中有8种不同化学环境的氢原子,苯环与酚羟基含有5种H原子,则另外侧链含有3种H原子,故另外侧链为-CH2CH2OOCH,-CH(CH3)OOCH,结构简式为:
)的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,Ⅲ.1H-NMR分析,分子中有8种不同化学环境的氢原子,苯环与酚羟基含有5种H原子,则另外侧链含有3种H原子,故另外侧链为-CH2CH2OOCH,-CH(CH3)OOCH,结构简式为:![]() 和
和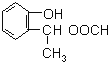 ;
;
(5)H的结构简式为![]() ,与足量的新制银氨溶液反应的化学方程式为
,与足量的新制银氨溶液反应的化学方程式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量乙炔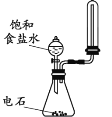
B. 制取并检验乙烯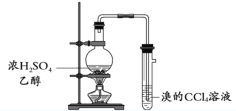
C. 检验溴乙烷与NaOH乙醇溶液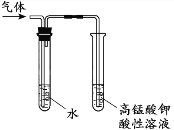
D. 制取并提纯乙酸乙酯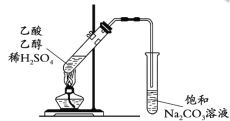
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
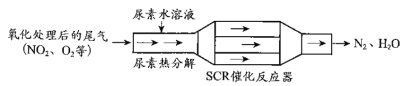
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
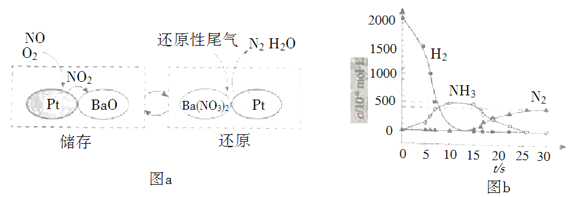
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: _______![]() □15NNO+□H2O_______
□15NNO+□H2O_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。

(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)
(2)试写出B溶液中的溶质的化学式:_____________
(3)写出化学方程式:
①铝土矿→A:_________________________________________________。
②E→F:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有铝、铁、铜的工业合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,其实验方案如图所示:

(1)合金与NaOH溶液反应的离子方程式为_________________________________________。
(2)方案中途径②的离子方程式________________________________________________,
D中加入适量盐酸的离子方程式为________________________________________________。
(3)滤渣F的主要成分为____________________
(4)CuSO4溶液中获得胆矾的操作为蒸发浓缩,_____________、过滤_,洗涤、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SiF6(氟硅酸)是一种基本化工原料,广泛用于制取氟硅酸盐及氟化物等。以氟硅酸和碳酸锂等为原料生产电池级LiF的工艺流程如图:
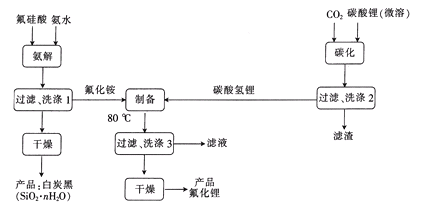
回答下列问题:
(1)生产中采用内衬为聚四氟乙烯或石墨的反应器。聚四氟乙烯的结构简式为____;不用陶瓷设备的原因是____。
(2)“氨解”时发生反应的化学方程式为____,氟化铵的电子式为____。
(3)“碳化”时发生反应的离子方程式为____。
(4)“制备”时产生的气体经分别吸收后返回____和___工序循环使用。
(5)H2SiF6水溶液中存在平衡:SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为___。
(6)某工厂用纯度为85%的氟硅酸14.4吨和纯度为90%的碳酸锂7.4吨来制备氟化锂,已知流程中氟元素的损耗率为10%,锂元素的损耗率为8%,则最终产品氟化锂为____吨(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请完成下列问题:
(1)通过表格中的数值可以推断:反应①是______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
(3)在相同温度下,根据反应①与②可推导出K3与K1、K2之间的关系式____________,据此关系式及上表数据,也能推断出反应③是_____(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ (填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度 D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)已知③的可逆反应CO (g) +H2O(g) ![]() CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com