
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
分析 A、氯气和液氯是两种状态不同组成相同的物质;
B、氯水中存在H2O?H++OH-,Cl2+H2O?HCl+HClO,HClO?H++ClO-三个平衡状态;
C.氯水中的次氯酸见光易分解,生成HCl和O2;
D.氯水中氯气和水反应生成的盐酸是酸,次氯酸具有强氧化性和漂白性.
解答 解:A、氯气和液氯是两种状态不同组成相同的物质,是同一物质,而不是不同的物质,故A错误;
B、氯水中存在H2O?H++OH-,Cl2+H2O?HCl+HClO,HClO?H++ClO-三个平衡状态,故B错误;
C.氯水中的次氯酸见光易分解,生成HCl和O2,酸性增强,pH减小,所有要保持在棕色瓶中,故C正确;
D.氯水中氯气和水反应生成的盐酸是酸使石蕊试液变红色,次氯酸具有强氧化性和漂白性,使红色褪去,故D正确;
故选AB.
点评 本题考查氯气的性质,为高频考点,侧重于学生的分析能力、实验能力和元素化合物知识的综合运用的考查,注意相关基础知识的积累与学习,难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式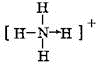 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | CH3COOH溶液加醋酸钠溶液,因醋酸根水解显碱性,电离平衡向正反应方向移动 | |
| C. | CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式:次氯酸: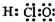 ;过氧化钠: ;过氧化钠: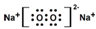 ;羟基: ;羟基: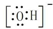 | |
| B. | KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化学式:聚异戊二烯: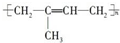 ;PVC: ;PVC: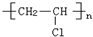 ;PE: ;PE: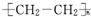 | |
| D. | 下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com