
【题目】近年来连续出现的铊中毒事件,给各科研单位及学校危险药品的管理敲响了警钟。铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期第________族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为____________。
(3)下列推断正确的是________。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强
【答案】 六 IIIA A-162 A B
【解析】(1)第五周期最后一种元素的原子序数为54,第六周期最后一种元素的原子序数为86,54<81<86,所以铊位于第六周期,第六周期最后一种元素为0族元素,从右往左逆推可知铊位于第IIIA,故铊在元素周期表中位于第六周期第IIIA。或者根据铊的外层电子构型6s26p1也可判断其在周期表中的位置。
(2)铊原子中中子数和质子数之差为(A-81)-81=A-162。
(3)铊与铝位于同一个主族,铊位于铝下面周期,铊的金属性大于铝的金属性,所以铊单质的还原性大于铝,氧化性Tl3+<Al3+,原子半径铊大于铝,最高价氧化物水化物碱性Tl(OH)3 >Al(OH)3,故说法正确的是A。
(4)根据铊的外层电子构型6s26p1可知失去一个电子形成Tl+,最外层还有2个电子,同时也能失去3个电子形成Tl3+,即Tl能形成+3价和+1价的化合物,根据氧化剂的氧化性大于氧化产物的氧化性可知Tl3+的氧化性比Ag+强,根据还原剂的还原性大于还原产物的还原性可知Tl+的还原性比Ag弱,故推断正确的是答案B。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.乙烯能与溴的四氯化碳溶液反应使溶液逐渐褪色
B.乙醛能与新制氢氧化铜反应产生砖红色沉淀
C.糖类物质都能发生水解反应
D.在一定条件下,氨基酸之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )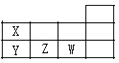
A.原子半径:Y>Z>W
B.酸性:HWO4>HXO3>H3YO4
C.热稳定性:HW>XH3>YH3
D.离子半径:Y3﹣<Z2﹣<W﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说法正确的是( )
A. 溴、碘单质和四氯化碳中都含有卤素
B. 溴、碘是单质,四氯化碳是化合物
C. Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列反应的化学方程式,并指出反应类型:
(1)用乙烯制备聚乙烯:________________________________;反应类型_________。
(2)乙醇在加热有铜作催化剂的条件下反应:______________________________;反应类型__________。
(3)乙酸乙酯在稀硫酸加热条件下水解:_________________________________________;反应类型__________。
II.现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH。请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、H2S等是极性分子,CO2,BF3,CCl4等是含极性键的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A. 分子中不能含有氢原子
B. 在ABn分子中A的相对原子质量应小于B的相对原子质量
C. 在ABn分子中A原子没有孤电子对
D. 分子中每个共价键的键长应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
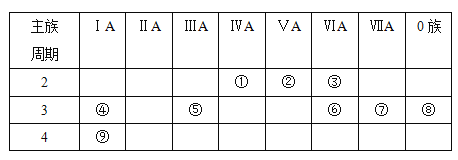
(1)在这些元素中,化学性质最不活泼的是________(填元素符号,下同)。
(2)从①到③的元素中,非金属性最强的是________
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是_________。
(4)最高价氧化物是两性氧化物的元素是_______;写出它的最高价氧化物与氢氧化钠反应的离子方程式_______________________________。
(5)用结构式表示元素①与③形成的一种可溶于水的化合物_________ 。
(6)写出元素④的单质与水反应的化学方程式________________________________。
(7)写出元素①的单质和元素⑥最高价氧化物对应水化物的浓溶液反应的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线_______(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_________。
CH3OH(g)的△H=_________。
(2)从反应开始到建立平衡,v(CO)=________;达到平衡时,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压 缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com