
分析 (1)醋酸是弱酸,电离可逆;
(2)利用氢离子的浓度计算pH;
(3)根据电离度及离子的浓度计算电离平衡常数;
(4)HAc电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度;
(5)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,由此分析解答.
解答 解:(1)醋酸是弱酸,电离可逆,电离方程式为CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(2)醋酸电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故答案为:4;
(3)由HAc═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为=$\frac{[{H}^{+}]•[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故答案为:1×10-7;
(4)醋酸电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,
故答案为:106;
(5)a.通入HCl气体,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.加入NaOH溶液,中和了溶液中的氢离子,则醋酸的电离程度增大,故正确;
c.加水稀释,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
故答案为:bc.
点评 本题考查弱酸的电离,明确离子的浓度,温度、浓度等对电离平衡的影响及离子积的计算即可解答,难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,ZX与水反应放出的气体的化学式为H2.
,ZX与水反应放出的气体的化学式为H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.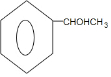 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com